Печеночные ферменты
Содержание:
- Электротранспортная цепь
- Нормы для пациентов разного возраста
- Схожі:
- Микросомальное окисление повышает реакционную способность молекул
- Микросомальные ферменты
- Ферменты, которые определяют для диагностики болезней печени
- Цирроз и изменения в биохимии
- Что такое ферменты печени
- Супероксиданион и перекись водорода
- Окисление оксидазного типа
- Активные формы кислорода
- Особая группа – микросомальные ферменты
- Примеры реакций оксигеназного типа
- Группы печеночных энзимов
Электротранспортная цепь
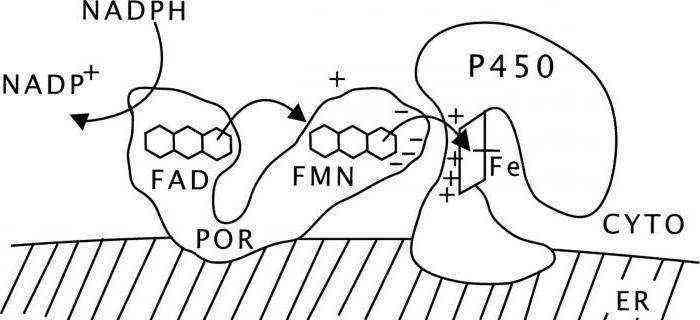
Микросомальная система окисления не имеет растворимых в цитоплазме компонентов, поэтому все ее ферменты собраны на поверхности эндоплазматического ретикулума. Эта система включает несколько белков, которые формируют электротранспортную цепь:
— НАДФ-Р450-редуктаза и цитохром Р450;
— НАД-цитохромВ5-редуктаза и цитохром В5;
— стеаторил-КоА-десатураза.
Донором электронов в подавляющем числе случаев выступает НАДФ (никотинамидадениндинуклеотидфосфа́т). Он окисляется НАДФ-Р450-редуктазой, который содержит два кофермента (ФАД и ФМН), для принятия электронов. В конце цепи ФМН окисляется при помощи Р450.
Нормы для пациентов разного возраста
Для лечения болезней печени обязательно проводят полную диагностику, которая включает в том числе биохимический анализ крови. Активность ферментов исследуют в комплексе, поскольку различные показатели могут свидетельствовать о разных нарушениях. В таблице представлены нормальные значения и их колебания.
| Соединение | Показатели нормы |
| Общий белок | 65—85 г/л |
| Холестерин | 3,5—5,5 ммоль/л |
| Общий билирубин | 8,5—20,5 мкмоль/л |
| Прямой билирубин | 2,2—5,1 мкмоль/л |
| Непрямой билирубин | Не более 17,1 мкмоль/л |
| АЛТ | Для мужчин — не более 45 ед/л; для женщин — не более 34 ед/л |
| АСТ | Для мужчин — не более 37 ед/л; для женщин — не более 30 ед/л |
| Коэффициент Ритиса | 0,9—1,7 |
| Щелочная фосфатаза | Не более 260 ед/л |
| ГГТ | Для мужчин — от 10 до 70 ед/л; для женщин — от 6 до 42 ед/л |
Фермент АЛС имеет наиболее важное диагностическое значение при подозрении на гепатит, жировую дистрофию или цирроз печени. Его значения в норме меняются со временем
Это соединение измеряют в единицах на 1 литр. Нормальные показатели в разном возрасте составят:
- у новорожденных – до 49;
- у детей до 6 месяцев – 56 и более;
- до года – не более 54;
- от 1 до 3 лет – до 33;
- от 3 до 6 лет – 29;
- у детей более старшего возраста и у подростков – до 39.
Лекарственные средства накапливаются в паренхиме печени и могут вызывать повышение активности ее ферментов
ВАЖНО! Биохимический анализ крови – это важное, но не единственное исследование, по которому определяют состояние печени. Также проводят УЗИ и дополнительные обследования по необходимости.
Схожі:
| Для самостоятельного изучения «Биохимия как наука. Этапы развития биохимии. Методы биохимических исследований» (Скоробогатова З. М.)Для самостоятельной работы студентов медицинского факультета, обучающихся по кредитно-модульной системе | Для самостоятельного изучения Биохимия как наука. Этапы развития биохимииДля самостоятельной работы студентов cтоматологического факультета, обучающихся по кредитно-модульной системе | ||
| Для самостоятельного изучения «Роль химических элемнтов в функцио- 5 нировании организма» (Землякова Л. Ф.)Для самостоятельной работы студентов медицинского факультета, обучающихся по кредитно-модульной системе | 3 Исследование биосинтеза и катаболизма пуриновых нуклеоти дов. Определение конечных продуктов их обмена (Хомутов Е. В.) 6Для самостоятельной работы студентов стоматологического факультета, обучающихся по кредитно-модульной системе | ||
| Методические рекомендации для студентов з курса медицинских факультетов по самостоятельной подготовке к практическим занятиям по общей хирургииМетодические рекомендации предназначены для самостоятельной подготовки к практическим занятиям по общей хирургии (модуль ІІ.) для… | Общая микробиология и иммунологияК практическим занятиям для студентов фармацевтического факультета, обучающихся по кредитно-модульной системе. Модуль 1 | ||
| «Общая и частная микробиология»Учебное пособие предназначено для студентов стоматологичес-кого факультета, обучающихся по кредитно-модульной системем. Оно объединяет… | Методические указания для студентов 3 курса медицинских факультетов по самостоятельной подготовке к практическим занятиям по общей хирургииМетодические указания предназначены для самостоятельной подготовки к практическим занятиям по общей хирургии (модуль І.) студентов… | ||
| Министерство образования и науки украины харьковская национальная академия городского хозяйства методические рекомендации для самостоятельной работы по курсуМетодические рекомендации для самостоятельного изучения курса «Аудит» (для студентов 4, 5 курсов заочной формы обучения фпо и зо:… | Методические указания для самостоятельной подготовки студентов к практическим занятиям по детским болезнямЕ. А. Бельская, И. М. Островский, М. С. Острополец, Е. А. Толстикова, Л. Л. Челпан, Н. А. Ходанич Методические указания для самостоятельной… |
Документи
Микросомальное окисление повышает реакционную способность молекул
Микросомальное окисление – это последовательность реакций с участием оксигеназ и НАДФН, приводящих к внедрению атома кислорода в состав неполярной молекулы и появлению у нее гидрофильности и повышает ее реакционную способность..
Реакции микросомального окисления осуществляются несколькими ферментами, расположенными на мембранах эндоплазматического ретикулума (в случае in vitro они называются микросомальные мембраны). Ферменты организуют короткие цепи, которые заканчиваются цитохромом P450.
Реакции микросомального окисления относятся к реакциям фазы 1 и предназначены для придания гидрофобной молекуле полярных свойств и/или для повышения ее гидрофильности, усиления реакционной способности молекул для участия в реакциях 2 фазы. В реакциях окисления происходит образование или высвобождение гидроксильных, карбоксильных, тиоловых и аминогрупп, которые и являются гидрофильными.
Ферменты микросомального окисления располагаются в гладком эндоплазматическом ретикулуме и являются оксидазами со смешанной функцией (монооксигеназами).
Цитохром P450
Основным белком микросомального окисления является гемопротеин – цитохром Р 450. В природе существует до 150 изоформ этого белка, окисляющих около 3000 различных субстратов. Соотношение разных изоформ цитохрома Р 450 различается в силу генетических особенностей. Считается, что одни изоформы участвуют в биотрансформации ксенобиотиков, другие – метаболизируют эндогенные соединения (стероидные гормоны, простагландины, жирные кислоты и др.).
Цитохром Р 450 взаимодействует с молекулярным кислородом и включает один атом кислорода в молекулу субстрата, способствуя появлению (усилению) у нее гидрофильности, а другой – в молекулу воды. Основными его реакциями являются:
- окислительное деалкилирование, сопровождающееся окислением алкильной группы (метил, этил) при атомах N, O или S до альдегидной и ее отщеплением,
- окисление (гидроксилирование) неполярных соединений с алифатическими цепями или ароматическими кольцами,
- окисление спиртов до соответствующих альдегидов.
Работа цитохрома Р450 обеспечивается двумя ферментами:
- НАДН‑цитохром b5‑оксидоредуктаза, содержит ФАД,
- НАДФН‑цитохром Р450‑оксидоредуктаза, содержит ФМН и ФАД.
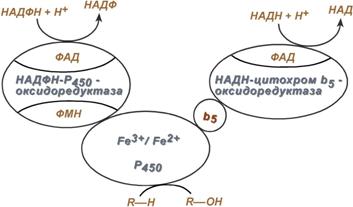
Схема взаиморасположения ферментов микросомального окисления и их функции
Обе оксидоредуктазы получают электроны от соответствующих восстановленных эквивалентов и передают их на цитохром Р450. Этот белок, предварительно присоединив молекулу восстановленного субстрата, связывается с молекулой кислорода. Получив еще один электрон, цитохром P450 осуществляет включение в состав гидрофобного субстрата первого атома кислорода (окисление субстрата). Одновременно происходит восстановление второго атома кислорода до воды.
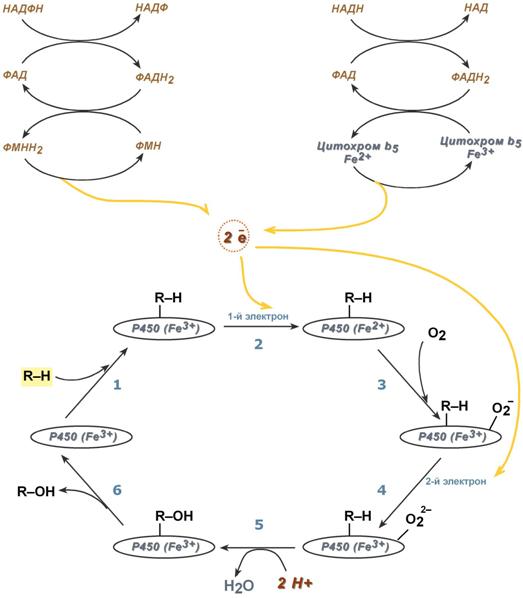
Последовательность реакций гидроксилирования субстратов с участием цитохрома Р 450
Существенной особенностью микросомального окисления является способность к индукции или ингибированию, т.е. к изменению мощности процесса.
Индукторами являются вещества, активирующие синтез цитохрома Р450 и транскрипцию соответствующих мРНК. Они бывают
1. Широкого спектра действия, которые обладают способностью стимулировать синтез цитохрома Р450, НАДФН-цитохром Р450-оксидоредуктазы и глюкуронилтрансферазы. Классическим представителем являются производные барбитуровой кислоты – барбитураты, также в эту группу входят диазепам, карбамазепин, рифампицин и др.
2. Узкого спектра действия, т.е. стимулируют одну из форм цитохрома Р450 – ароматические полициклические углеводороды (метилхолантрен, спиронолактон), этанол.
Ингибиторы микросомального окисления связываются с белковой частью цитохрома или с железом гема. Они делятся на:
1. Обратимые
- прямогодействия – угарный газ (СО), антиоксиданты,
- непрямогодействия, т.е. влияют через промежуточные продукты своего метаболизма, которые образуют комплексы с цитохромом Р450 – эритромицин.
2. Необратимые ингибиторы – аллопуринол, аминазин, прогестерон, оральные контрацептивы, тетурам, фторурацил,
Микросомальные ферменты
Эндоплазматический ретикулум гепатоцитов производит полостные образования – микросомы, содержащие на своих мембранах группу микросомальных ферментов. Их предназначение – обезвреживание ксенобиотиков и эндогенных соединений путем окисления. Система включает в себя несколько ферментов, среди них цитохром Р450, цитохром b5 и другие. Эти энзимы обезвреживают лекарственные препараты, алкоголь, токсины.
Окисляя лечебные вещества, микросомальная система ускоряет их выведение и снижает время действия на организм. Некоторые вещества способны повышать активность цитохрома, тогда говорят об индукции микросомальных энзимов. Это проявляется ускорением распада лекарства. Индукторами могут выступать алкоголь, рифампицин, фенитоин, карбамазепин.
Другие лекарственные препараты ингибируют миросомальные ферменты, что проявляется удлинением жизни лекарства и увеличением его концентрации. В роли ингибиторов могут выступать флюконазол, циклоспорин, дилтиазем, верапамил, эритромицин.
Внимание! Учитывая возможность ингибирования или индукции микросомальных реакций, только врач может правильно назначить несколько препаратов одновременно без вреда для больного. Роль микросомального окисления в жизни организма сложно переоценить или не заметить
Инактивация ксенобиотиков (ядовитых веществ), распад и образование гормонов надпочечников, участие в обмене белков и сохранении генетической информации – это лишь малая известная толика проблем, которые решаются благодаря микросомальному окислению. Это автономный процесс в организме, который запускается после попадания триггерного вещества и заканчивающийся с его эллиминацией
Роль микросомального окисления в жизни организма сложно переоценить или не заметить. Инактивация ксенобиотиков (ядовитых веществ), распад и образование гормонов надпочечников, участие в обмене белков и сохранении генетической информации – это лишь малая известная толика проблем, которые решаются благодаря микросомальному окислению. Это автономный процесс в организме, который запускается после попадания триггерного вещества и заканчивающийся с его эллиминацией.
Ферменты, которые определяют для диагностики болезней печени
Биохимия крови – это важный этап диагностики болезней печени. Все патологические процессы в этом органе могут происходить с явлениями холестаза или цитолиза. Первый процесс представляет собой нарушение оттока желчи, которую выделяют гепатоциты. При остальных нарушениях происходит разрушение здоровых клеточных элементов с высвобождением их содержимого в кровь. По наличию и количеству энзимов печени в крови можно определить стадию болезни и характер патологических изменений в органах гепатобилиарного тракта.
Показатели холестаза
Синдром холестаза (затруднение желчеотделения) сопровождает воспалительные заболевания печени, нарушение секреции желчи и патологии желчевыводящих путей. Эти явления вызывают следующие изменения в биохимическом анализе:
- экскреторные энзимы повышены;
- увеличены также компоненты желчи, в том числе билирубин, желчные кислоты, холестерин и фосфолипиды.
Отток желчи может нарушаться при механическом давлении на желчные протоки (воспаленной тканью, новообразованиями, камнями), сужении их просвета и других явлениях. Комплекс характерных изменений показателей крови становится основанием для более подробного исследования состояния желчного пузыря и желчевыводящих путей.
Индикаторы цитолиза
Цитолиз (разрушение гепатоцитов) может происходить при инфекционных и незаразных гепатитах либо при отравлениях. В таком случае содержимое клеток высвобождается, а индикаторные ферменты появляются в крови. К ним относятся АЛТ (аланинаминотрансфераза), АСТ (аспартатаминотрансфераза), ЛДГ (лактатдегидрогеназа) и альдолаза. Чем выше показатели этих соединений в крови, тем обширнее степень поражения паренхимы органа.
Определение щелочной фосфатазы
Щелочная фосфатаза, которая обнаруживается в крови, может иметь не только печеночное происхождение. Небольшое количество этого фермента вырабатывается костным мозгом. О заболеваниях печени можно говорить, если происходит одновременное повышение уровня ЩФ и гамма-ГГТ. Дополнительно может обнаруживаться увеличение показателей билирубина, что говорит о патологиях желчного пузыря.
Гамма-глютамилтранспептидаза в крови
ГГТ обычно повышается с щелочной фосфатазой. Эти показатели свидетельствуют о развитии холестаза и о возможных заболеваниях желчевыводящей системы. Если этот фермент повышается изолированно, есть риск незначительного повреждения печеночной ткани на начальных стадиях алкоголизма или других отравлениях. При более серьезных патологиях наблюдается одновременное увеличение печеночных энзимов.
Окончательный диагноз можно поставить только на основании комплексного обследования, которое включает УЗИ
Трансаминазы печени (АЛТ, АСТ)
АЛТ (аланинаминотрансфераза) – это наиболее специфичный фермент печени. Он находится в цитоплазме и других органов (почек, сердца), но именно в печеночной паренхиме он присутствует в наибольшей концентрации. Его повышение в крови может указывать на различные заболевания:
- гепатит, интоксикации с повреждением печени, цирроз;
- инфаркт миокарда;
- хронические заболевания сердечно-сосудистой системы, которые проявляются некрозом участков функциональной ткани;
- травмы, повреждения или ушибы мышц;
- тяжелая степень панкреатита – воспаления поджелудочной железы.
АСТ (аспартатдегидрогеназа) находится не только в печени. Ее также можно обнаружить в митохондриях сердца, почек и скелетных мускулов. Повышение этого фермента в крови указывает на разрушение клеточных элементов и развитие одной из патологий:
- инфаркта миокарда (одна из наиболее распространенных причин);
- заболеваний печени в острой или хронической форме;
- сердечной недостаточности;
- травм, воспаления поджелудочной железы.
ВАЖНО! В исследовании крови и определении трансфераз имеет значение соотношение между ними (коэффициент Ритиса). Если он АСТ/АЛС превышает 2, можно говорить о серьезных патологиях с обширным разрушением паренхимы печени.
Лактатдегидрогеназа
ЛДГ относится к цитолитическим ферментам. Она не является специфичной, то есть обнаруживается не только в печени
Однако ее определение имеет важное значение при диагностике желтушного синдрома. У пациентов с болезнью Жильбера (генетическим заболеванием, которое сопровождается нарушением связывания билирубина) она находится в пределах нормы
При остальных видах желтух ее концентрация повышается.
Цирроз и изменения в биохимии
Патология печени, связанная с перестройкой ткани, вызывает изменения во всех функциях органа. Отмечается повышение неспецифических и специфических ферментов. Высокий уровень последних характерен для цирроза. Это такие энзимы:
аргиназа;фруктозо-1-фосфатальдолаза;нуклеотидаза.
В биохимическом анализе можно заметить изменения и других показателей. Альбумин снижается менее 40 г/л, глобулины могут увеличиваться. Холестерин становится менее 2 ммоль/л, мочевина ниже 2,5 ммоль/л. Возможно увеличение гаптоглобина.
Значительно увеличивается билирубин за счет роста прямой и связанной формы.
Что такое ферменты печени
Исходя из своих функции, энзимы располагаются внутри клетки, на клеточной мембране, входят в состав различных клеточных структур и участвуют в реакциях внутри нее. По выполняемой функции выделяют следующие группы:
гидролазы – расщепляют молекулы веществ;синтетазы – участвуют в молекулярном синтезе;трансферазы – транспортируют участки молекул;оксиредуктазы – влияют на окислительно-восстановительные реакции в клетке;изомеразы – меняют конфигурацию молекул;лиазы – образуют дополнительные молекулярные связи.
Работа многих энзимов требует присутствия дополнительных ко-факторов. Их роль выполняют все витамины, микроэлементы.
Супероксиданион и перекись водорода
Эти вещества активны не только в месте образования, но и на некотором удалении от них, так как могут проникать через мембраны клеток.
Гидроксильная группа вызывает окисление остатков аминокислот: гистидина, цистеина и триптофана. Это приводит к инактивации ферментных систем, а также нарушению работы транспортных белков. Кроме того, микросомальное окисление аминокислот приводит к разрушению структуры нуклеиновых азотистых оснований и, как следствие, страдает генетический аппарат клетки. Окисляются и жирные кислоты, входящие в состав билипидного слоя клеточных мембран. Это влияет на их проницаемость, работу мембранных электролитных насосов и на расположение рецепторов.
Ингибиторы микросомального окисления – это антиоксиданты. Они содержатся в продуктах питания и вырабатываются внутри организма. Самым известным антиоксидантом является витамин Е. Эти вещества могут сдерживать микросомальное окисление. Биохимия описывает взаимодействие между ними по принципу обратной связи. То есть чем больше оксидаз, тем сильнее они подавляются, и наоборот. Это помогает сохранять равновесие между системами и постоянство внутренней среды.
Окисление оксидазного типа
Реакции микросомального окисления происходят вне митохондрий, поэтому на них расходуется около десяти процентов всего кислорода, попадающего в организм. Основные ферменты в этом процессе – оксидазы. В их структуре присутствуют атомы металлов с переменной валентностью, такие как железо, молибден, медь и другие, а значит, они способны принимать электроны. В клетке оксидазы расположены в особых пузырьках (пероксисомах), которые находятся на внешних мембранах митохондрий и в ЭПР (зернистый эндоплазматический ретикулюм). Субстрат, попадая на пероксисомы, теряет молекулы водорода, которые присоединяются к молекуле воды и образуют перекись.
Существует всего пять оксидаз:
— моноаминооксигеназа (МАО) – помогает окислять адреналин и другие биогенные амины, образующиеся в надпочечниках;
— диаминооксигеназа (ДАО) – участвует в окислении гистамина (медиатор воспаления и аллергии), полиаминов и диаминов;
— оксидаза L-аминокислот (то есть левовращающихся молекул);
— оксидаза D-аминокислот (правовращающихся молекул);
— ксантиноксидаза – окислят аденин и гуанин (азотистые основания, входящие в молекулу ДНК).
Значение микросомального окисления по оксидазному типу состоит в устранении ксенобиотиков и инактивации биологически активных веществ
Образование перекиси, оказывающей бактерицидное действие и механическое очищение в месте повреждения, является побочным явлением, которое занимает важное место среди прочих эффектов
Активные формы кислорода
Кислород является потенциально опасным веществом, так как, по сути, окисление – это процесс горения. В виде молекулы О2 или воды он стабилен и химически инертен, потому что его электрические уровни заполнены, и новые электроны не могут присоединиться. Но соединения, в которых у кислорода не у всех электронов есть пара, имеют высокую реакционную способность. Поэтому их называют активными.
Такие соединения кислорода:
- В монооксидных реакциях образуется супероксид, который отделяется от цитохрома Р450.
- В оксидазных реакциях идет образование пероксидного аниона (перекиси водорода).
- Во время реоксигенации тканей, которые подверглись ишемии.
Самым сильным окислителем является гидроксильный радикал, он существует в свободном виде всего миллионную долю секунды, но за это время успевает пройти множество окислительных реакций. Его особенностью является то, что гидроксильный радикал воздействует на вещества только в том месте, в котором образовался, так как не может проникать через ткани.
Особая группа – микросомальные ферменты
Микросомальные ферменты печени – это особая группа белков, которые вырабатываются эндоплазматической сетью. Они принимают участие в реакциях обезвреживания ксенобиотиков (веществ, которые являются чужеродными для организма и могут вызывать симптомы интоксикации). Эти процессы проходят в две стадии. В результате первой из них водорастворимые ксенобиотики (с низкой молекулярной массой) выводятся с мочой. Нерастворимые вещества проходят ряд химических превращений с участием микросомальных ферментов печени, а затем элиминируются в составе желчи в тонкий отдел кишечника.
Основной элемент, который вырабатывается эндоплазматической сетью клеток печени, – цитохром Р450. Для лечения некоторых заболеваний применяют препараты-ингибиторы или индукторы микросомальных ферментов. Они оказывают влияние на активность этих белков:
- ингибиторы – ускоряют действие ферментов, благодаря чему действующие вещества препаратов быстрее выводятся из организма (рифампицин, карбамазепин);
- индукторы – снижают активность ферментов (флюконазол, эритромицин и другие).
ВАЖНО! Процессы индукции или ингибирования микросомальных ферментов учитывают при подборе схемы лечения любого заболевания. Одновременный прием лекарственных средств этих двух групп противопоказан
Ферменты печени – это важный диагностический показатель для определения заболеваний печени. Однако для комплексного исследования необходимо также провести дополнительные анализы, в том числе УЗИ. Окончательный диагноз ставят на основании клинического и биохимического анализов крови, мочи и кала, УЗИ органов брюшной полости, по необходимости – рентгенографии, КТ, МРТ или других данных.
В настоящее время описано более 250 химических соединений, вызывающих индукцию микросомальных ферментов. К числу этих индукторов относят барбитураты, полициклические ароматические углеводороды, спирты, кетоны и некоторые стероиды. Несмотря на разнообразие химического строения, все индукторы имеют ряд общих признаков; их относят к числу липофильных соединений, и они служат субстратами для цитохрома Р450.
Индукция защитных систем.
Многие ферменты, участвующие в первой и второй фазе обезвреживания, − индуцируемые белки. Ещё в древности царь Митридат знал, что если сисгематически принимать небольшие дозы яда, можно избежать острого отравления. «Эффект Митридата» основан на индукции определённых защитных систем.
В мембранах ЭР печени цитохрома Р-450 содержится больше (20%), чем других мембрано-связанных ферментов. Лекарственное вещество фенобарбитал активирует синтез цитохрома Р-450, УДФ-глюкуронилтрансферазы и эпоксид гидролазы. Например, у животных, которым вводили индуктор фенобарбитал, увеличивается площадь мембран ЭР, которая достигает 90% всех мембранных структур клетки, и, как следствие, — увеличение количества ферментов, участвующих в обезвреживании ксенобиотиков или токсических веществ эндогенного происхождения.
При химиотерапии злокачественных процессов начальная эффективность лекарства часто постепенно падает. Более того, развивается множественная лекарственная устойчивость, т.е. устойчивость не только к этому лечебному препарату, но и целому ряду других лекарств. Это происходит потому, что противоопухолевые лекарства индуцируют синтез Р-гликопротеина, глутатионтрансферазы и глутатиона. Использование веществ, ингибирующих или активирующих синтез Р-гликопротеина, а также ферменты синтеза глутатиона, повышает эффективность химиотерапии.
Металлы являются индукторами синтеза глутатиона и низкомолекулярного белка металлотионеина, имеющих SH-группы, способные связывать их. В результате возрастает устойчивость клеток организма к ядам и лекарствам.
Повышение количества глутатионтрансфераз увеличивает способность организма приспосабливаться к возрастающему загрязнению внешней среды. Индукцией фермента объясняют отсутствие антиканцерогенного эффекта при применении ряда лекарственных веществ. Кроме того, индукторы синтеза глутатионтрансферазы — нормальные метаболиты — половые гормоны, йодтиронины и кортизол. Катехоламины через аденилатциклазную систему фосфорилируют глутатионтрансферазу и повышают её активность.
Ряд веществ, в том числе и лекарств (например, тяжёлые металлы, полифенолы, S-алкилы глутатиона, некоторые гербициды), ингибируют глутатионтрансферазу.
Примеры реакций оксигеназного типа
Как уже упоминалось выше, монооксигеназы для окисления используют только один атом кислорода из двух, имеющихся в наличии. Второй они присоединяют к двум молекулам водорода и образуют воду. Одним из примеров такой реакции может служить образование коллагена. Донором кислорода в таком случае выступает витамин С. Пролингидроксилаза отбирает у него молекулу кислорода и отдает его пролину, который, в свою очередь, входит в молекулу проколлагена. Этот процесс придает прочности и эластичности соединительной ткани. Когда в организме дефицит витамина С, то развивается подагра. Она проявляется слабостью соединительной ткани, кровотечениями, гематомами, выпадением зубов, то есть качество коллагена в организме становится ниже.
Еще одним примером могут служить гидроксилазы, которые преобразуют молекулы холестерина. Это один из этапов образования стероидных гормонов, в том числе и половых.
Группы печеночных энзимов
От локализации печеночных ферментов зависит их функция в процессах клеточного обмена. Так, митохондрии участвуют в обмене энергии, гранулярная эндоплазматическая сеть синтезирует белки, гладкая – жиры и углеводы, на лизосомах находятся белки-гидролазы. Все энзимы, которые вырабатывает печень, можно обнаружить в крови.
В зависимости от того, какие функции выполняют энзимы и где они находятся в организме, их разделяют на 3 большие группы:
- секреторные – после секреции клетками печени поступают в кровь и находятся здесь в максимальной концентрации (факторы свертываемости крови, холинэстераза);
- индикаторные – в норме содержатся внутри клеток и высвобождаются в кровь только при их повреждении, поэтому могут служить индикаторами степени поражения печени при ее заболеваниях (АЛТ, АСТ и другие);
- экскреторные – выводятся из печени с желчью, а повышение их уровня в крови свидетельствует о нарушении этих процессов.
Для диагностики состояния печени имеет значение каждый из энзимов. Их активность определяют при подозрении на основные патологии печени и для оценки степени повреждения печеночной ткани. Для получения более полной картины может потребоваться также диагностика пищеварительных ферментов, энзимов желудочно-кишечного тракта, поджелудочной железы и желчевыводящих путей.