Химические свойства спиртов
Содержание:
Как из алканов получить альдегиды и карбоновые кислоты
После разрешения проблемы дешевого сырья для спиртовой промышленности химики знают, как из алкана получить альдегид с наименьшими затратами. Один из способов получения ацетальдегида — гидратация ацетилена. Весь процесс идет по схеме: природный газ → СН4 → С2Н2 → СН3—СОН. Возросло использование природных углеводородов для выпуска этилового спирта. Вещество является сырьем для производства карбонильных и карбоксильных соединений. Ацетальдегид можно получить при дегидрировании этана с последующим образованием в реакции этилового спирта, его окислением или дегидрированием. Один из вариантов — окисление этилена: С2Н6 → С2Н4 → С2Н4О. Как из алкана получить карбоновую кислоту? Вопрос, который длительное время находился в разряде проблемных. Уксусная кислота образуется при сбраживании пищевого сырья, при сухой перегонке древесины. Наличие доступных источников алканов позволяет проводить окисление бутана и получать дешевую уксусную кислоту: С4Н10 + 2 ½ О2 → 2СН3СООН + Н2О. Налажен выпуск других карбоновых кислот из предельных и непредельных углеводородов.

Современное мировое хозяйство трудно представить без природного газа, нефти и каменноугольного сырья. Из этих природных смесей выделяют различные алканы, которые используют для производства большого числа продуктов органического синтеза.
Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
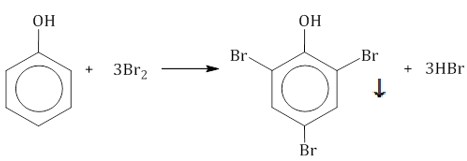
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
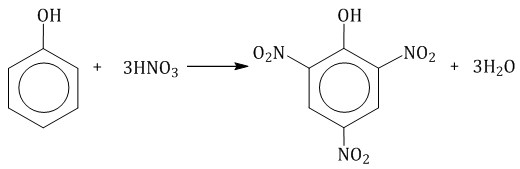
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
Как из алкана получить алкан
В промышленности практически все виды предельных углеводородов получают из нефтегазового сырья. Переработка нефти — современный метод получения алканов из алканов:
А) Жидкие предельные углеводороды дает прямая перегонка нефти (низкий выход целевых продуктов).
Б) Термический и каталитический крекинги нефти применяют для увеличения процентного содержания легких фракций, улучшения качества получаемых углеводородов (бензина, керосина). В соляровой фракции нефти присутствует гексадекан, который при распаде дает додекан и бутилен. Додекан уже в составе керосиновой фракции подвергается дальнейшему распаду, из него получают предельный углеводород нонан и пропен (алкен). Продолжение крекинга может привести к образованию гептана и этилена.
Реакции окисления алканов
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:
Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре
Продукт реакции – так называемый «синтез-газ».
Возможные переходы между органическими соединениями
В составе месторождений «черного золота» часто присутствуют циклоалканы или нафтены. Переработка сырья дает предельные циклические углеводороды, содержащие 5–7 атомов С в кольце, они имеют наибольшее практическое значение. Как из алкана получить циклоалкан, если запасы нафтенов истощены? Для получения предельных циклических углеводородов из насыщенных ациклических соединений применяют способ дегидроциклизации. Цепочки из 4-х и более атомов С замыкаются, возникает устойчивый цикл. Другие типичные превращения органических веществ можно отразить в простых схемах:
- Нефть → углеводороды → алканы → карбоновые кислоты.
- Природный газ → предельные углеводороды → карбоновые кислоты.
- Каменный уголь → углеводороды → алканы → непредельные углеводороды → полимеры.
- Нефть → углеводороды → арены → бензол → изопропил-бензол → ацетон, фенол.
- Природный газ → непредельные углеводороды → этанол.
- Каменный уголь → метанол.
- Нефть → углеводороды → алкены → бутадиен и изопрен.
Рассмотрим подробнее, какие химические соединения удается получить благодаря генетическому родству органических веществ.
Как из алкана получить алкан
В промышленности практически все виды предельных углеводородов получают из нефтегазового сырья. Переработка нефти — современный метод получения алканов из алканов:
А) Жидкие предельные углеводороды дает прямая перегонка нефти (низкий выход целевых продуктов).
Б) Термический и каталитический крекинги нефти применяют для увеличения процентного содержания легких фракций, улучшения качества получаемых углеводородов (бензина, керосина). В соляровой фракции нефти присутствует гексадекан, который при распаде дает додекан и бутилен. Додекан уже в составе керосиновой фракции подвергается дальнейшему распаду, из него получают предельный углеводород нонан и пропен (алкен). Продолжение крекинга может привести к образованию гептана и этилена.
Окисление этилового спирта до уксусной кислоты
Микробиология —
Превращение микроорганизмами соединений углерода
Этиловый спирт окисляется до уксусной кислоты под влиянием уксуснокислых бактерий, относящихся к родам Gluconobacter и Acetobacter. Это грамотрицательные хемоорганогетеротрофные, не образующие спор, палочковидные организмы, подвижные или неподвижные.
Два рода уксуснокислых бактерий различаются между собой по характеру жгутикования клеток. У представителей рода Gluconobacter клетки движутся при помощи 3—8 полярных жгутиков, редко одного, или неподвижные. Бактерии рода Acetobacter движутся при помощи перитрихиальных жгутиков или неподвижные.
Уксуснокислые бактерии — строгие аэробы, поэтому они развиваются только на поверхности среды, и для них весьма характерно образование пленок. Одни виды этих организмов образуют тонкие пленки, состоящие лишь из одного слоя клеток, другие формируют пленки более толстые, иногда напоминающие папиросную бумагу. Некоторые уксуснокислые бактерии дают пленки слизистые, толстые. Уксуснокислые бактерии отличаются высокой устойчивостью к кислотам (могут расти в среде с начальным pH 4, оптимум pH 5—6). Эти бактерии обнаруживают на поверхности растений (цветков, плодов), на разлагающихся растительных остатках и т. д.
Характерная особенность уксуснокислых бактерий – их способность превращать этиловый спирт в уксусную кислоту:
СН3СН2ОН + О2 -» СН3СООН + Н2О
Два рода уксуснокислых бактерий различаются по степени окисления органических субстратов. Так, уксуснокислые бактерии рода Acetobacter (A. peroxydans) накапливают уксусную кислоту в качестве промежуточного продукта и могут подвергать ее дальнейшему окислению до СО2 и Н2О (эти бактерии называют переокислителями), а бактерии рода Gluconobacter (G. oxydans) вызывают образование уксусной кислоты как конечного продукта реакции, который обычно не подвергается последующему окислению (эти бактерии называют иедоокислителями). Способность видов рода Acetobacter окислять уксусную кислоту до СО2 объясняется наличием у них цикла трикарбоновых кислот. Уксуснокислые бактерии способны окислять не только этиловый спирт, но и другие спирты, в том числе алифатические многоатомные.
Кроме указанных окислительных процессов, уксуснокислые бактерии могут вызывать окисление сорбита до сорбозы, маннита до фруктозы, глюкозы до глюконовой кислоты, глюконовой кислоты до кетоглюконовых кислот. Эти окислительные превращения осуществляются по пентозофосфатному пути представителями рода Gluconobacter. Особый интерес представляет окисление уксуснокислыми бактериями D — сорбита до L — сорбозы. Последняя требуется в больших количествах для синтеза витамина С.
Интересно отметить, что представитель рода Acetobacter — Acetobacter xylinum при росте на среде с глюкозой или другими источниками углерода способен образовывать внеклеточную слизистую пленку, состоящую из чистой целлюлозы. Целлюлозные фибриллы представляют собой рыхлую массу, окружающую клетки бактерий. В культуре эти организмы образуют пленку толщиной 1 см и более, состоящую из целлюлозы и бактериальных клеток.
Уксуснокислых бактерий используют для производства пищевого уксуса из вина и спирта.
Химические свойства алканов
Реакции замещения.
Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу. Приведем уравнения характерных реакций галогенирования:
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.Реакция дегидрирования (отщепления водорода).
В ходе пропускания алканов над катализатором (Pt, Ni, А1203, Сг203) при высокой температуре (400-600 °С) происходит отщепление молекулы водорода и образование алкена:Реакции, сопровождающиеся разрушением углеродной цепи.
Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться.
1. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
В общем виде реакцию горения алканов можно записать следующим образом: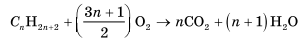 2. Термическое расщепление углеводородов.
2. Термическое расщепление углеводородов.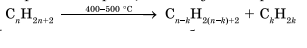
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов.
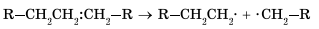
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
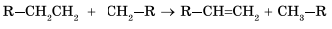
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
3. Пиролиз. При нагревании метана до температуры 1000 °С начинается пиролиз метана — разложение на простые вещества:
При нагревании до температуры 1500 °С возможно образование ацетилена:
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом: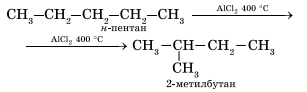
5. Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных: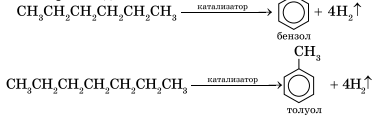
Алканы вступают в реакции, протекающие по свободнорадикальному механизму, т. к. все атомы углерода в молекулах алканов находятся в состоянии sp3-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод — углерод) связей и слабополярных С—Н (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т. к. связи в молекулах алканов не разрываются по гетеролитическому механизму.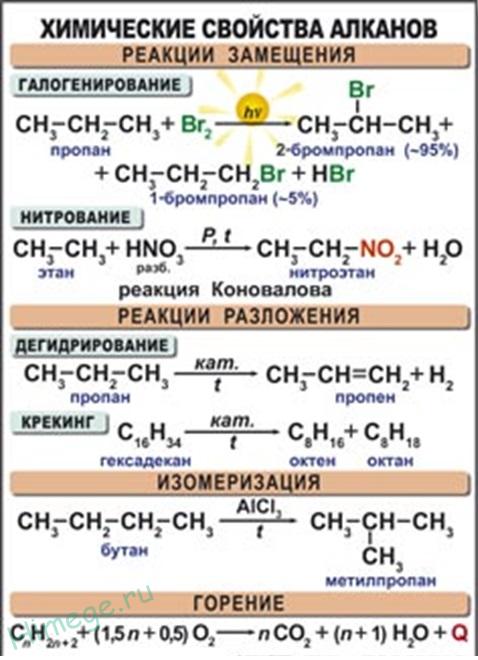
Оптическая изомерия
Если атом углерода в молекуле связан с четырьмя различными заместителями (атомами или атомными группами), например:
то возможно существование двух соединений с одинаковой структурой, но различным пространственным строением.Молекулы таких соединений относятся друг к другу, как зеркальные изображение и предмет. При этом никаким вращением нельзя получить одну молекулу из другой.
Номенклатура алканов
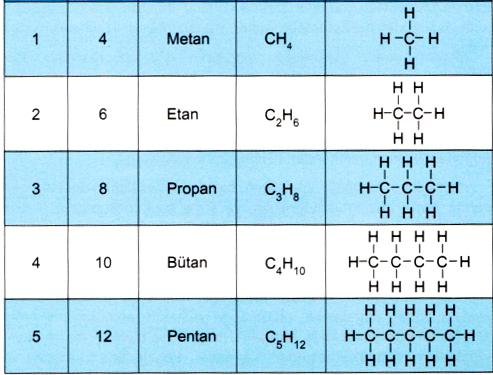
В названиях алканов используется суффикс -АН.
|
Например, алкан имеет название 2-метилпропан. |
Для простейших алканов (метан, этан, пропан, бутан и изобутан) используют тривиальные названия. Начиная с пятиатомного углероводорода, в названии неразветвленных (нормальных) алканов используют корень, который показывает число атомов углерода в молекуле, и добавляют соответствующий суффикс (для алканов – ан, для алкенов – ен, и т.д.).
Название разветвленных алканов строится по следующим правилам:
1. Выбирают главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями. При этом главная цепь должна быть самой длинной. Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а:
| а | б |
Главная цепь должна быть самой разветвленной.
Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от цепи на рисунке б – только один:
| а | б |
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Например, 2-метилпропан:
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 2,2-диметилпропан или 2,2,3-триметилпентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 2,2-диметил-3-этилпентан.
5. Называют главную углеродную цепь, т.е. соответствующий нормальный алкан.
Например, название молекулы на рисунке:
2,2,4-триметил-4-этилгексан
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
Как получить этиловый и другие спирты из алканов
В древности над вопросом: «Как из алкана получить спирт?» не размышляли, наши предки использовали только способ спиртового брожения сахаросодержащих продуктов под действием ферментов дрожжей. Рост технического значения этилового спирта привел к поиску новых видов непищевого сырья для получения этанола. В первой половине минувшего столетия вещество стало незаменимым сырьем для производства каучука по методу Лебедева. Один из методов был предсказан еще А. М. Бутлеровым, который мечтал, что дешевый способ получения этилена откроет путь «для добывания спирта». Источниками непредельных углеводородов служат продукты крекинга нефти и каталитическое дегидрирование алканов. Из этана получают этилен, который окисляется в присутствии серной кислоты: С2Н6 → С2Н4 → С2Н5ОН. Гидратация других алкенов, которые также получают при переработке нефти, дает гомологи синтетического этилового спирта. Недостатки способа выражаются в затратах на регенерацию кислоты и защиту аппаратов от ее коррозийного воздействия. Промышленность перешла на метод прямой гидратации алкенов, в котором применяются твердые катализаторы. Метанол получают при окислении метана. Этилен и его гомологи служат сырьем для производства спиртов.
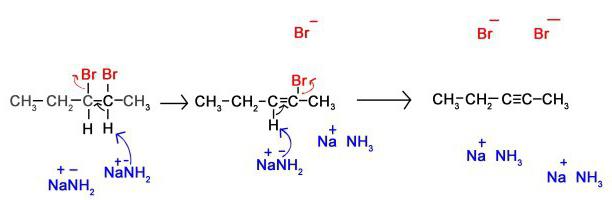
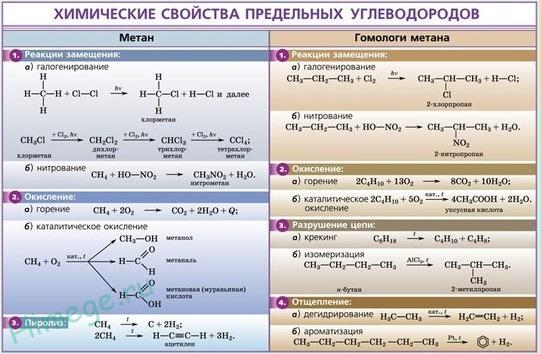
Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
| Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: |
Бромирование протекает более медленно и избирательно.
|
Избирательность бромирования: сначала замещается атом водорода у третичного атома углерода, затем атом водорода у вторичного атома углерода, и только затем первичный атом.
С третичный–Н > С вторичный–Н > С первичный–Н |
|
Например, при бромировании 2-метилпропана преимущественно образуется 2-бром-2-метилпропан: |
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование алканов
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
|
Например. При нитровании пропана образуется преимущественно 2-нитропропан: |
Как из алкана получить ацетилен
Углеводород с одной тройной связью — ацетилен — очень важен в промышленной отрасли, строительстве и других областях хозяйственной деятельности. Старейший способ получения этого простейшего алкина связан с действием воды на твердые кусочки карбида кальция. На смену этому методу пришел крекинг природного газа. Теперь на предприятиях химической отрасли знают, как из алкана получить алкин с наименьшими затратами. В специальных технологических аппаратах при высокой температуре или под действием электрического разряда происходит дегидрирование метана — преобладающего вещества природного газа: 2СН4 → HC≡CH + 3Н2. Ацетилен находит широкое применение, из него получают ацетальдегид, который далее используется в производстве уксусной кислоты, искусственных смол, пластмасс, синтетических волокон, каучуков и резин.
Электролиз солей карбоновых кислот (электролиз по Кольбе)
Это электролиз водных растворов солей карбоновых кислот.
В общем виде:
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
В водном растворе ацетат натрия практически полностью диссоциирует:
CH3COONa → CH3COO– + Na+
При этом на катод притягиваются катионы натрия Na+ и молекулы воды H2O.
Разряжаться на катоде будут молекулы воды:
Kатод(-): 2H2O + 2e = H2 + 2OH–
На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы.
При этом от карбоксильной группы отрывается углекислый газ и остаются метильные радикалы, которые образуют газообразный этан:
Aнод(+): 2CH3COO– – 2e = 2CO2 + CH3–CH3
Суммарное уравнение электролиза водного раствора ацетата натрия:
2CH3COONa + 2H2O = H2 + 2NaOH + 2CO2 + CH3–CH3
Некоторые особенности окисления в ЕГЭ, с которыми мы не совсем согласны.
Те «правила», принципы и реакции, которые будут рассмотрены в этом разделе, мы считаем не совсем корректными. Они противоречат не только реальному положению дел (химии как науке), но и внутренней логике школьной программы и ЕГЭ в частности.
Но тем не менее, мы вынуждены дать этот материал именно в том виде, который требует ЕГЭ.
Речь пойдет именно о ЖЕСТКОМ окислении.
Помните, как окисляются гомологи бензола и их произсодные в жестких условиях? Радикалы все обрываются – образуются карбоксильные группы. Обрывки подвергаются окислению уже «самостоятельно»:

Так вот, если вдруг радикале появляется гидроксильная группа, или кратная связь, нужно забыть, что там есть бензольное кольцо. Реакция пойдет ТОЛЬКО по этой функциональной группе (или кратной связи).
Функциональная группа и кратная связь главнее бензольного кольца.
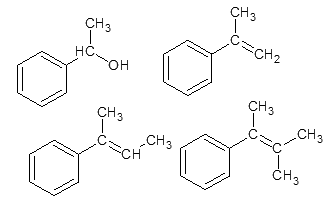
Разберем окисление каждого вещества:
Первое вещество:
Нужно не обращать внимание на то, что есть бензольное кольцо. С точки зрения ЕГЭ – это всего лишь вторичный спирт
Вторичные спирты окисляются до кетонов, а кетоны далее не окисляются:
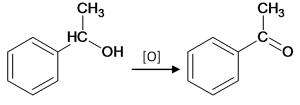
Пусть это вещество у нас будет окисляться бихроматом:

Второе вещество:
Это вещество окисляется, просто как соединение с двойной связью (на бензольное кольцо не обращаем внимание):

Пусть оно будет окисляться в нейтральном перманганате при нагревании:
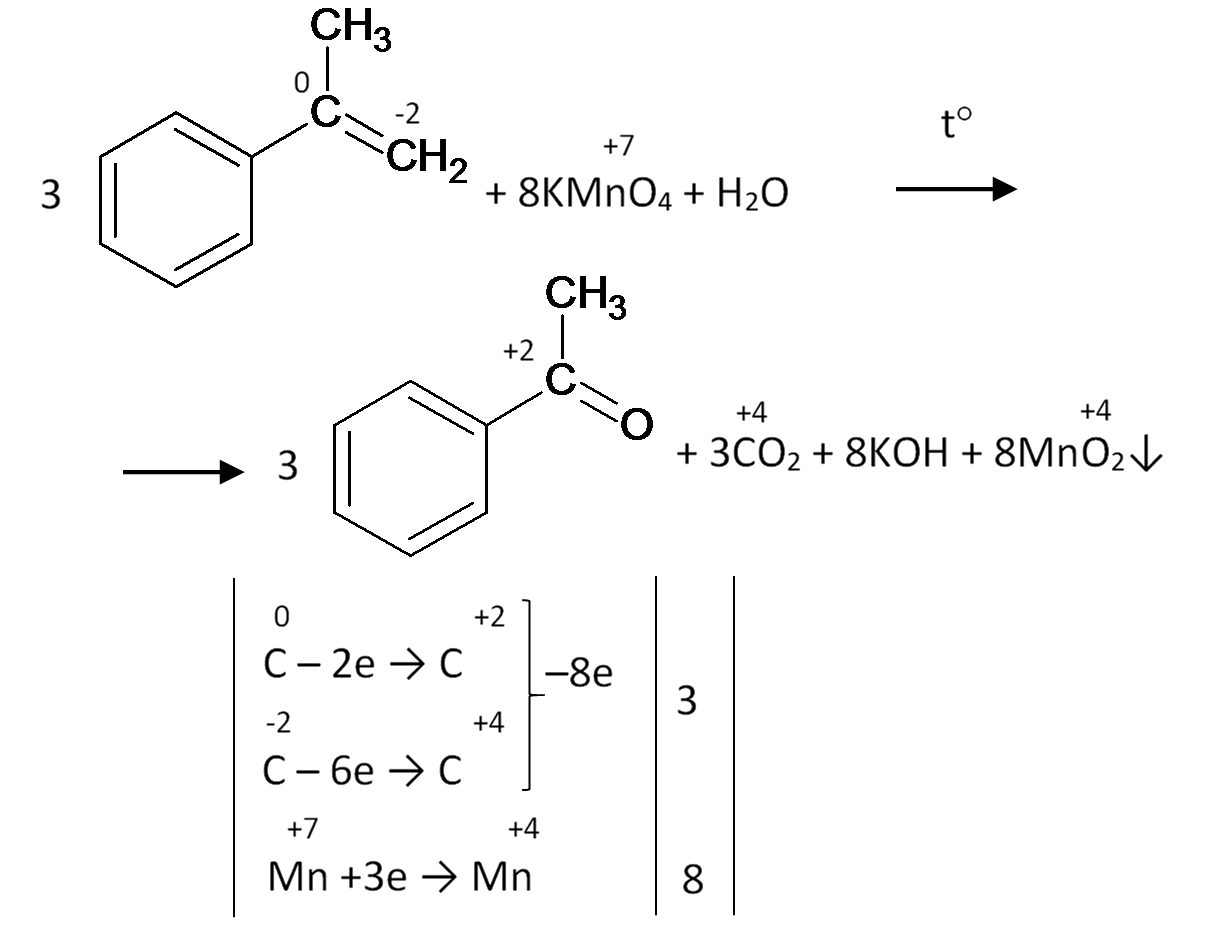
Образовавшейся щелочи хватает на полную нейтрализацию углекислого газа:
2KOH + CO2 → K2CO3 + H2O
Итоговое уравнение:

Окисление третьего вещества:
Пусть окисление будет протекать перманганатом калия в кислой среде:
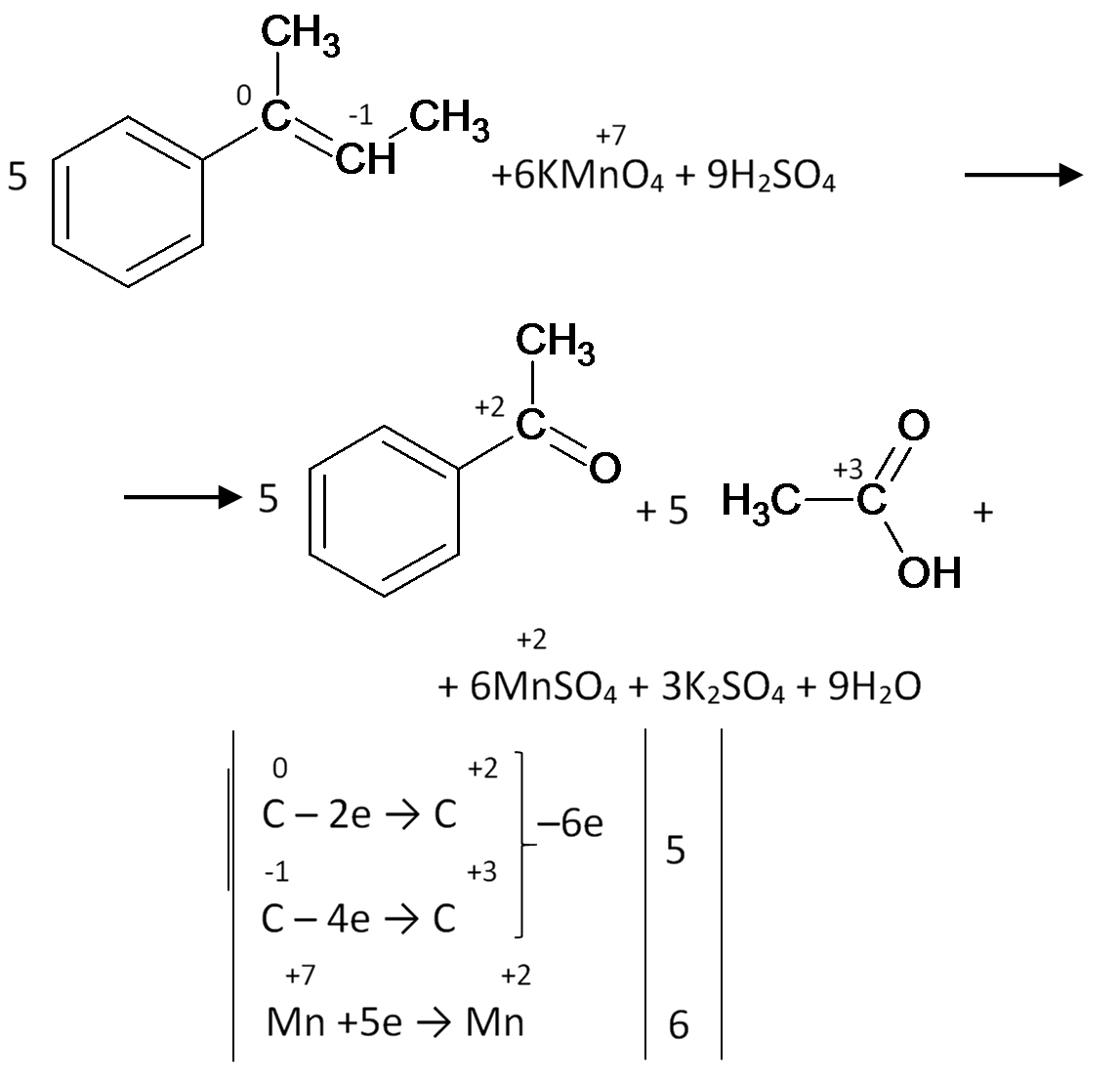
Окисление четвертого вещества:
Оно пусть окисляется в сильнощелочной среде. Уравнение реакции будет:
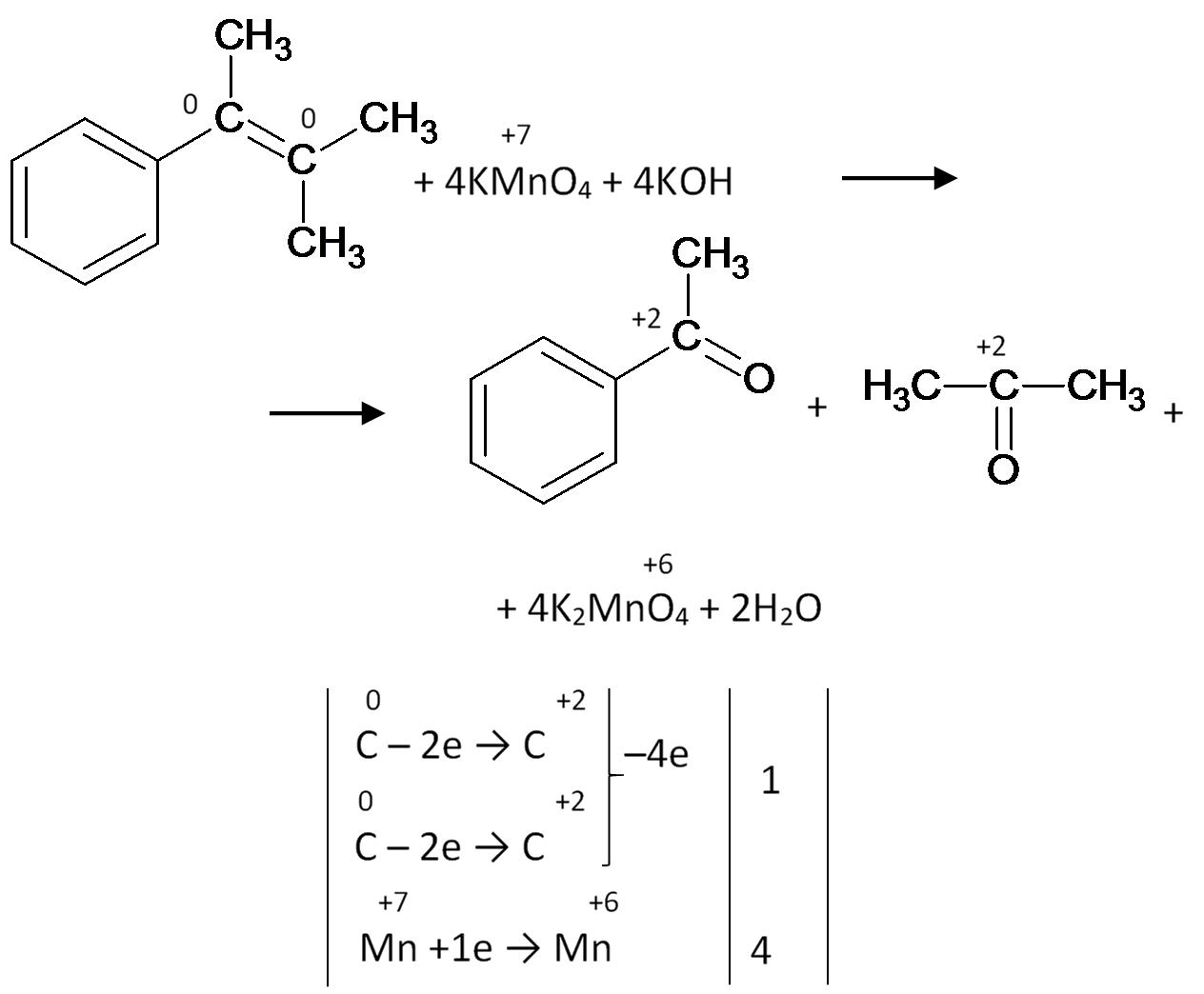
Ну и напоследок, вот так окисляется винилбензол:
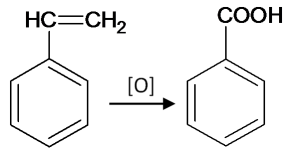
А окисляется он до бензойной кислоты, нужно иметь ввиду, что по логике ЕГЭ он так окисляется не потому, что он – производное бензола. А потому, что он содержит двойную связь.
Реакции разложения
2.1. Дегидрирование и дегидроциклизация
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
| Например, при дегидрировании этана образуются этилен или ацетилен: |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
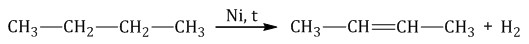
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:

Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
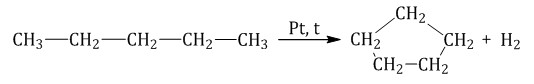
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
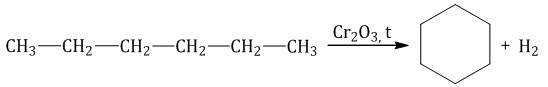
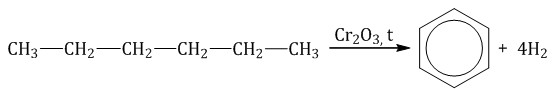
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
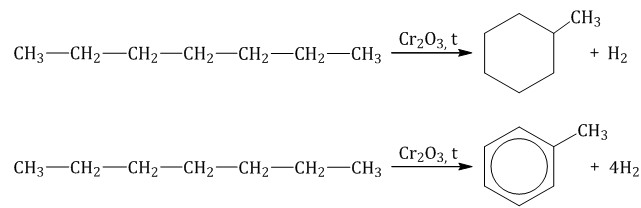
2.2. Пиролиз (дегидрирование) метана
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
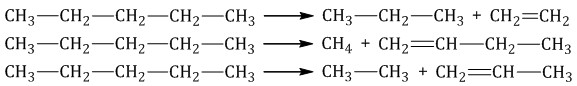
2.3. Крекинг
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
|
Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды.
|
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).