Аммиак, получение, свойства, химические реакции
Содержание:
Как раствор аммиака применяет в медицине?
Для изготовления раствора аммиака применяется дистиллированная вода и гидроксид аммония. В результате получается бесцветная и прозрачная жидкость с резким специфическим запахом. Она применяется как фармацевтическое средство и продается в аптеках. Но с помощью раствора аммиака можно удовлетворить и множество бытовых нужд.
Однако обо всем по порядку, и начнем с физиологического действия нашатыря и его применения в медицине.
Раствор аммиака определяется как местно-раздражающее вещество, прежде всего, влияющее на чувствительные нервные окончания верхних дыхательных путей. Это обычно окончания тройничного нерва, раздражение которых обуславливает рефлекс по стимулированию дыхательного и сосудодвигательного центров мозга. Как результат у человека участится дыхание и повысится артериальное давление, но при чрезмерном пресыщении возможна и остановка дыхания. Бесконтрольное и чрезмерное злоупотребление раствора аммиака характеризуется развитием побочных эффектов от препарата. Среди них боль в желудке и рвота, понос с тенезмами, кашель и отек гортани, судороги и коллапс, в исключительных случаях летальный исход.
Перорально раствор аммиака принимать не рекомендуется, поскольку слизистая оболочка желудка раздражится и спровоцируется рвотный рефлекс. Нужно отметить, что при некоторых обстоятельствах, когда рвоту спровоцировать необходимо, прием нашатыря внутрь оправдан. Стимулирующее действие нашатырь оказывает и на эпителий дыхательных путей, что ловко используется для муколитического действия. Для такого рода воздействий с добавлением раствора аммиака готовят смеси для ингаляций.
Итак, в терапевтических целях раствор аммиака назначают:
- для преодоления обморочного состояния путем возбуждения дыхательных центров — в растворе аммиака необходимо смочить лоскут ткани или ватный диск и аккуратно поднести к ноздрям; нескольких секунд взаимодействия будет достаточно;
- для провокации рвотного рефлекса (например, при отравлении алкоголем) — раствор аммиака нужно разбавить водой (100 мл воды и 5-10 капель нашатыря) и принять внутрь; ни в коем случае не употребляйте раствор аммиака в чистом виде;
- для облегчения симптомов при укусах насекомых — из нашатыря готовятся примочки или линименты, для чего его смешивают с другими компонентами (как минимум водой, а то и эфирными маслами, органическими кислотами и т.д.);
- при невралгиях, миозитах, радикулитах — раствор аммиака применяют наружно, им растирают пораженные участки тела, чем обеспечивается отвлекающее и местно-раздражающее действие, возбуждаются рецепторы кожи;
- для антисептического эффекта — раствором аммиака можно дезинфицировать руки перед оперативным вмешательством (по методу Спасокукоцкого-Кочергина), с добавлением нашатыря можно готовить и антисептические повязки на кожные повреждения.
В то же время крайне важно соблюдать с нашатырем осторожность и чаще всего применять его в разведенном виде. В чистом виде при воздействии на кожные покровы нашатырь может вызвать ожоги, а если его принять внутрь, то ожог распространится по слизистой оболочке пищевода и желудка, что совсем нежелательно. Вдыхание высококонцентрированных паров аммиака способно спровоцировать рефлекторную остановку дыхания, вот поэтому ватку с нашатырем лучше не прикладывать к ноздрям, а лишь провести ею рядом с носом
Вдыхание высококонцентрированных паров аммиака способно спровоцировать рефлекторную остановку дыхания, вот поэтому ватку с нашатырем лучше не прикладывать к ноздрям, а лишь провести ею рядом с носом.
Физиологическое действие и токсикология
Аммиак NH3 (аммониак, нитрид водорода) относится к умеренно-токсичным химическим веществам, однако в больших концентрациях (как и другие пниктогеноводороды) он может стать сильным ядом для человека.
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³.
Предельно допустимая концентрация аммиака в воздухе рабочей зоны производственного помещения (ПДКр.з.) составляет 20 мг/м³. В атмосферном воздухе населённых пунктов и в жилых помещениях среднесуточная концентрация аммиака (ПДКс.с.) не должна превышать 0,04 мг/м³. Максимальная разовая концентрация в атмосфере — 0,2 мг/м³. Таким образом, ощущение запаха аммиака свидетельствует о превышении допустимых норм.
Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м³, глаз — 490 мг/м³. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7—14 г/м³ — эритематозный, 21 г/м³ и более — буллёзный дерматит. Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м³. Кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более быстро приводит к развитию общетоксических эффектов.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Туркестанской (ранее — Южно-Казахстанской) области Казахстана.
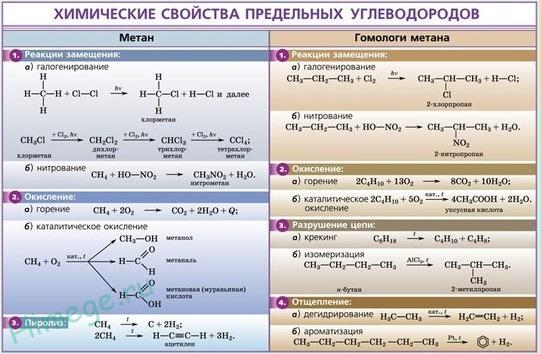
Химические свойства аммиака:
Основные свойства аммиака обусловлены наличием неподеленной пары электронов у атома азота. Степень окисления азота в аммиаке «-3» – минимальная. Поэтому в химическом отношении аммиак довольно активен: он вступает в реакции взаимодействия со многими веществами и проявляет только восстановительные свойства.
Для аммиака характерны следующие химические реакции:
1. реакция взаимодействия аммиака и воды:
NH3 + H2O ⇄ NH3•H2O.
В результате реакции образуется гидрат аммония (NH3•H2O или NH4OН). Раствор аммиака в воде имеет щелочную среду.
NH3•H2O → NH3 + H2O (to).
При кипении гидрат аммиака разлагается с образованием аммиака и воды.
2. реакция взаимодействия аммиака и ортофосфорной кислоты:
NH3 + H3PO4 → NH4H2PO4.
В результате реакции образуется дигидрофосфат аммония.
Аналогичным образом протекают реакции аммиака с другими кислотами – с образованием солей аммония.
3. реакция взаимодействия аммиака и кислорода – горения аммиака:
4NH3 + 3O2 → 2N2 + 6H20.
В результате реакции образуется азот и вода. Реакция носит необратимый характер.
4. реакция каталитического окисления аммиака:
4NH3 + 5O2 → 4NO + 6H2O (kat = Pt и пр., t = 800 оС);
NH3 + 2O2 → HNO3 + H2O (kat = Pt, Rh, t = 850 оС, p = 5 атм.).
В результате первой реакции образуются оксид азота (II) и вода. В качества катализатора используются платина и ее сплавы с металлами-платиноидами, оксиды железа, марганца, кобальта, хрома и др.
В результате второй реакции образуются азотная кислота и вода. Это промышленный способ получения азотной кислоты. При этом смесь воздуха с 10% (по объему) аммиака пропускается над рядами металлических сеток (платина с 5-15% родия) при температуре около 850 оС и давлении 5 атм; время контактирования с катализатором ограничено до ≤ 1 мс чтобы минимизировать нежелательные побочные реакции. Степень превращения составляет около 96% (одна из наиболее эффективных из известных промышленных каталитических реакций); выходящие газы пропускают через абсорбционную колонну и получают 60%-й водный раствор азотной кислоты при 40°C. Реакция протекает в три стадии.
5. реакция взаимодействия аммиака и оксида меди:
2NH3 + 3CuO → N2 + 3Cu + 3H2O (t = 500-550 оС).
В результате реакции образуются азот, медь и вода. В ходе реакции аммиак пропускается через нагретый оксид меди.
6. реакция термического разложения аммиака:
2NH3 ⇄ N2 + 3H2 (t = 1200-1300 оС).
В результате реакции образуются азот и водород.
7. реакция взаимодействия аммиака и фтора:
2NH3 + 3F2 → 6HF + N2 (tо).
В результате реакции образуются фтороводород и азот. Реакция происходит при высоких температурах.
Аналогичным образом протекают реакции аммиака с другими галогенами.
8. реакция взаимодействия оксида калия и аммиака:
K2O + NH3 → KNH2 + KOH (t = -50 оС).
В результате реакции образуются амид калия и гидроксид калия. Реакция медленно протекает в жидком аммиаке.
Применение раствора аммиака для обработки комнатных цветов
Среди прочих преимуществ применения аммиачного раствора для ухода за комнатными цветами стоит выделить такой важный фактор, как профилактика почвенного окисления, обеспечиваемая благодаря щелочным свойствам используемого соединения, что позволяет обойтись без старой доброй извести. Другое дело, что для каждого случая актуальны свои концентрации и частота их внесения.
От мошки и других вредителей
Самой распространенной причиной, по которой применяется нашатырь на декоративных культурах, является травля паразитов. И в этом случае выбор оптимальной дозировки будет напрямую зависеть от того, о каких именно вредителях идет речь. Для наглядности имеет смысл привести самые распространенные их виды и методы борьбы с ними:
- Дрозофилы. Не секрет, что эти мушки появляются в слишком влажной среде, образующейся при чрезмерном поливе грунта, буквально за считанные дни создавая огромные популяции. Решить эту стремительно прогрессирующую проблему вполне реально, если ежедневно проливать грунт концентрированным раствором, приготовленным в расчете 1 ст. л. нашатыря на литр воды. Прибегать к этому приему рекомендуется до тех пор, пока мушки не исчезнут, в случае необходимости повторяя процедуру спустя несколько дней.
- Тля. В отличие от дрозофилы, эти мелкие насекомые крайне опасны, поскольку их основной пищей является сок растений. Однако решается и эта проблема, для чего необходимо смешать 1 ст. л. препарата с 3 л воды, внося полученный концентрат под корень.
- Долгоносик. Этот паразит предпочитает все части растений без исключения, также представляя собой серьезную угрозу. А для того чтобы избавиться от непрошеного гостя, следует смешать 1 ч. л. спирта с литром воды, проводя ежедневную обработку.
Совет!Не стоит забывать и о таком эффективном способе борьбы со всеми этими жучками-паучками, как опрыскивание зеленой части растения. В этом случае необходимо использовать более слабый концентрат, разводя 1 ст. л. средства в 5, а не в 1 литре.
Для подкормки
Если внешний вид цветка оставляет желать лучшего, то это значит, что пора подкармливать его азотом, используя стандартную пропорцию, в которой на 1 л холодной очищенной воды приходится 1 ст. л. спиртового раствора. Поливать цветы нужно под корень, не чаще чем 1-2 раза в 14 дней
Если же в этот период наблюдается активная бутонизация, то крайне важно не перекормить и без того ослабленное растение азотом. В этом случае нужно использовать менее концентрированные растворы, а также избегать опрыскивания и попадания на завязь

Для дезинфекции инвентаря и кашпо
Одно из самых опасных воздействий способны оказывать различные патогенные бактерии и микроорганизмы, включая грибковую инфекцию. Между тем, избежать заражения вполне реально, просто обработав горшки нашатырным раствором, используя разные концентрации. К аналогичным приемам прибегают и тогда, когда в горшке погибло растение, но выбрасывать тару для выращивания совсем не хочется.
В этом случае на выручку придет дезинфицирующий раствор, приготовленный на основе растворенного в горячей воде нашатыря в пропорции 60 мл на 5 л. Для достижения максимального эффекта можно добавить к этой смеси натертого на терке хозяйственного мыла в количестве 100 г.

Химические свойства[править]
Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как нуклеофил или комплексообразователь. Так, он присоединяет протон, образуя ион аммония:
NH3 + H+ = NH4+
С кислотами даёт соответствующие соли аммония:
NH3 + HNO3 = NH4NO3
Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса
NH3 + H2O = NH4+ + OH-
С галогеноалканами вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
NH3 + CH3Cl → CH3NH3Cl (гидрохлорид метиламмония)
С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
Аммиак также является очень слабой кислотой (более слабой, чем вода), способен образовывать с металлами соли — амиды.
Аммиак горит в атмосфере кислорода, давая воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты.
4NH3 + 3O2 → 2N2 + 6H20
Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
Окислением аммиака гипохлоритом натрия в присутствии желатина получают гидразин.
При 1000°C аммиак реагирует с углем, образуя HCN и частично разлагаясь на азот и водород.
Поведение в почве
При внесении аммиачной воды в почву аммиак адсорбируется почвенными коллоидами, поэтому его передвижение незначительно. Впоследствии аммиачный азот нитрифицируется, приобретает большую степень подвижности и мигрирует с почвенным раствором.
Внесение аммиачной воды повышает количество почвенных микроорганизмов, поскольку аммиак увеличивает количество растительных остатков, которыми питаются микроорганизмы. При этом непосредственно после внесения удобрения в почву в зоне его распространения наблюдается уменьшение количества почвенных микроорганизмов. После превращения аммиака в нитраты (это происходит весной за шесть недель) микроорганизмы сразу же размножаются в удобренной почве. Аммиачная вода убивает и дождевых червей. Однако их количество тоже быстро восстанавливается и даже увеличивается после превращения аммиака в нитраты или поглощения его растениями.
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявляется его сходство с водой:
-
- 2NH3⟶NH4++NH2−{\displaystyle {\ce {2NH3 -> NH4^+ + NH2^-}}}.
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg{\displaystyle {\ce {Mg}}}, Al{\displaystyle {\ce {Al}}}, а также Eu{\displaystyle {\ce {Eu}}} и Yb{\displaystyle {\ce {Yb}}}. В отличие от воды с жидким аммиаком данные металлы не реагируют, а именно растворяются и могут быть выделены в исходном виде при испарении растворителя. Растворимость щелочных металлов в жидком NH3{\displaystyle {\ce {NH3}}} составляет несколько десятков процентов. В жидком аммиаке NH3{\displaystyle {\ce {NH3}}} также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например, Na4Pb9{\displaystyle {\ce {Na4Pb9}}}.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щёлочноземельные — в виде комплексов с аммиаком Э(NH3)6{\displaystyle {\ce {}}}, обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3{\displaystyle {\ce {NH3}}}.
Растворённый в NH3{\displaystyle {\ce {NH3}}} металл постепенно реагирует с образованием амида:
-
- 2Na+2NH3⟶2NaNH2+H2{\displaystyle {\ce {2Na + 2NH3 -> 2NaNH2 + H2}}}.
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−{\displaystyle {\ce {NH2^-}}}, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li{\displaystyle {\ce {Li}}} к Cs{\displaystyle {\ce {Cs}}}. Реакция значительно ускоряется в присутствии даже небольших примесей H2O{\displaystyle {\ce {H2O}}}.
Металлоаммиачные растворы обладают металлической проводимостью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окружённые молекулами NH3{\displaystyle {\ce {NH3}}}. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Подкормка растений нашатырным спиртом: рецепты проверенные временем
Нашатырный спирт для цветов и культурных растений можно использовать в качестве подкормки или другими словами удобрения почвы. Производить полив грунта можно как в период высадки рассады (по , 1 литру в каждую лунку), так и в период вегетации растения.
Аммиачный раствор применение для капусты
Обработка капусты нашатырным спиртом — эффективный способ уберечь ее от улиток, гусениц, крестоцветной блошки, медведки, капустной мухи и слизней.
Для опрыскивания листьев используется раствор №2 (см. таблицу выше), для полива под корень раствор №1. Полив не более 1 раза в неделю. Опрыскивание чаще однократное, но по мере необходимости можно повторить еще раз.
Нашатырный спирт как удобрение для рассады помидор и других пасленовых культур
Для формирования крепких кустов и образования больших плодов томатам растениям необходима азотистая подкормка. Нашатырный раствор способен дать мощный заряд азота помидорам. Его можно вносить, как при посадке рассады томатов из расчета по 0,5 литра в лунку, а также при необходимости можете поливать помидоры под корень 1 раз в неделю. Для этих целей используйте раствор №1 (см. таблицу).
Подкормка лука и чеснока нашатырным спиртом
Если вы обнаружили, что листья лука или чеснока желтеют и скручиваются, то, скорее всего растение сигнализирует о наличии азотистого голодания. В этом случае стоит удобрить культуру азотосодержащим удобрением. Для этого готовят 1% раствор нашатырки и производят полив растений не чаще чем 1 раз в 7 дней. Обработка культуры от луковой мухи осуществляется более концентрированным составом, о котором описано ниже.
Нашатырная подкормка для огурцов или как оживить листья
Наверное, в своей практике вы неоднократно наблюдали картину несвоевременного пожелтения огуречных листьев с последующим их высыханием. Такое явление говорит о потере львиной доли урожая, поэтому бороться с ним нужно начинать уже при первых симптомах в виде легкой потери цвета.
После того, как побег достиг 10-15 см можно начинать подкармливать культуру слабым (1%-ным) раствором нашатыря 1 раз в неделю. В момент формирования завязей практикуют более частую подкормку более концентрированным раствором (№2 см. таблицу выше).
Если же вы заметили явную потерю цвета на огуречной ботве взрослого растения, то лучше произвести единоразовый полив огурцов концентрированный раствором для экстренной обработки (раствор №4 в таблице).
Важно не применяйте нашатырный спирт в саду и огороде совместно с другими азотосодержащими удобрениями. Переизбыток данного вещества может нанести большой вред урожаю!
Оксид азота(II)
NO – бесцветный газ, является одним из продуктов каталитической термической диссоциации аммиака в присутствии кислорода:
NO образуется также при термическом разложении азотной кислоты или при реакции меди с разбавленной азотной кислотой:
NO можно получать синтезом из простых веществ (N2 и O2) при очень высоких температурах, например в электрическом разряде. В структуре молекулы NO имеется один неспаренный электрон. Соединения с такой структурой взаимодействуют с электрическим и магнитным полями. В жидком или твердом состоянии оксид имеет голубую окраску, поскольку неспаренный электрон вызывает частичную ассоциацию в жидком состоянии и слабую димеризацию в твердом состоянии: 2NO N2O2.
Химические
Степень окисления азота в составе аммиака – -3, водорода – +1. При образовании аммиака водород окисляет азот, отнимая у него три электрона. За счёт оставшейся пары электронов азота и лёгкого отделения атомов водорода аммиак является активным соединением, вступающим в реакции с простыми и сложными веществами.
Основные химические свойства описаны в таблице.
|
Взаимодействие |
Продукты реакции |
Уравнение |
|
С кислородом |
Горит с образованием азота или взаимодействует с кислородом в присутствии катализатора (платины), образуя оксид азота |
– 4NH3 +3O2 → 2N2 + 6H2O; – 4NH3 + 5O2 → 4NO + 6H2O |
|
С галогенами |
Азот, кислота |
2NH3 + 3Br2 → N2 + 6HBr |
|
С водой |
Гидроксид аммония или нашатырный спирт |
NH3 + H2O → NH4OH |
|
С кислотами |
Соли аммония |
– NH3 + HCl → NH4Cl; – 2NH3 + H2SO4 → (NH4)2SO4 |
|
С солями |
Замещает металл, образуя новую соль |
2NH3 + CuSO4 → (NH4)2SO4 + Cu |
|
С оксидами металлов |
Восстанавливает металл, образуется азот |
2NH3 + 3CuO → 3Cu + N2 + 3H2O |
Рис. 3. Горение аммиака.
Что мы узнали?
Выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный лёгкий газ с резким запахом. Сжижается при низкой температуре. Раствор аммиака – хороший растворитель. Способен отдавать атомы водорода, присоединяя углеводородный радикал и образуя амины. Аммиак за счёт оставшейся электронной пары азота реагирует с простыми и сложными веществами – галогенами, кислородом, водой, кислотами, солями, оксидами.
Производители аммиака
Производители аммиака в России
| Компания | 2006, тыс. т | 2007, тыс. т |
|---|---|---|
| ОАО «Тольяттиазот» | 2 634 | 2 403,3 |
| ОАО НАК «Азот» | 1 526 | 1 514,8 |
| ОАО «Акрон» | 1 526 | 1 114,2 |
| ОАО «Невинномысский азот», г. Невинномысск | 1 065 | 1 087,2 |
| ОАО «Минудобрения» (г. Россошь) | 959 | 986,2 |
| ОАО «АЗОТ» г. Кемерово [прояснить] | 854 | 957,3 |
| ОАО «Азот»[прояснить] | 869 | 920,1 |
| ОАО «ЗМУ КЧХК» | 956 | 881,1 |
| ОАО Череповецкий «Азот» | 936,1 | 790,6 |
| ЗАО «Куйбышевазот» | 506 | 570,4 |
| ОАО «Газпром Нефтехим Салават» | 492 | 512,8 |
| «Минеральные удобрения» (г. Пермь) | 437 | 474,6 |
| ОАО «Дорогобуж» | 444 | 473,9 |
| ОАО «Воскресенские минеральные удобрения» | 175 | 205,3 |
| ОАО «Щекиноазот» | 58 | 61,1 |
| — | — | |
| Итого | 13 437,1 | 12 952,9 |
На долю России приходится около 9 % мирового выпуска аммиака. Россия — один из крупнейших мировых экспортёров аммиака. На экспорт поставляется около 25 % от общего объёма производства аммиака, что составляет около 16 % мирового экспорта.
По итогам 2014 года в России было произведено 14,8 млн тонн аммиака (+2 % к 2013 году) (по данным Росстата). Производство аммиака в России сконцентрировано в Приволжском федеральном округе (46 % по итогам 2014 года). Далее следуют Центральный федеральный округ (23 %) и Северо-Западный федеральный округ (16 %).
Порядка 25 % российского производства аммиака отправляется на экспорт. Так, в 2014 году объём российского экспорта аммиака (по данным ФТС) составил составил 3,6 млн тонн (+6 % к 2013 году) на сумму 1,6 млрд долл. США.
Ключевыми странами-получателями в 2014 году стали Украина, Финляндия и Литва.
Производители аммиака на Украине
| Компания | 2008 |
|---|---|
| ПАО «Концерн Стирол» | 1 331 |
| Одесский припортовый завод | 1 128 |
| Северодонецкое объединение Азот | 1 015 |
| «Азот» (Черкассы) | 778 |
| «Днепроазот» | 515 |
| «Ровноазот» | 382 |
| Итого | 5 149 |
Комплексообразование
Благодаря своим электронодонорным свойствам молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
-
- CuSO4+4NH3⟶Cu(NH3)4SO4{\displaystyle {\ce {CuSO4 + 4NH3 -> SO4}}}.
- Ni(NO3)2+6NH3⟶Ni(NH3)6(NO3)2{\displaystyle {\ce {Ni(NO3)2 + 6NH3 -> (NO3)2}}}.
Комплексообразование обычно сопровождается изменением окраски раствора. Так, в первой реакции голубой цвет (CuSO4{\displaystyle {\ce {CuSO4}}}) переходит в тёмно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO3)2{\displaystyle {\ce {Ni(NO3)2}}}) в сине-фиолетовую. Наиболее прочные комплексы с NH3{\displaystyle {\ce {NH3}}} образуют хром и кобальт в степени окисления +3.
Примечания
- ↑
- Correlation of the Base Strengths of Amines 1 (англ.) // J. Am. Chem. Soc.
- Малина И.К. Синтез аммиака // Книга для чтения по неорганической химии. Пособие для учащихся. Ч. II. — М.: Просвещение, 1975. — С. 52—62.
- Adjei, M. B.; Quesenberry, K. H. and Chamblis, C. G. . University of Florida IFAS Extension (июнь 2002).
- Zschocke, Johannes, and Georg Hoffman. Vademecum Metabolism (неопр.). — Friedrichsdorf, Germany: Milupa GmbH, 2004.
- Rose, Burton, and Helmut Rennke. Renal Pathophysiology (неопр.). — Baltimore: Williams & Wilkins (англ.)русск., 1994. — ISBN 0-683-07354-0.
- Campbell, Neil A. (англ.)русск.. 44 // Biology (неопр.). — 6th. — San Francisco: Pearson Education, Inc (англ.)русск., 2002. — С. 937—938. — ISBN 0-8053-6624-5.
- ГОСТ 12.1.005-88. Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
- СанПиН 2.1.2.1002-00. Санитарно-эпидемиологические требования к жилым зданиям и помещениям
- Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 19. Взаимодействие азота с водородом // Неорганическая химия. Учебник для 9 класса. — 7-е изд. — М.: Просвещение, 1976. — С. 38—41. — 2 350 000 экз.
- Гордон А., Форд Р. Спутник химика.//Перевод на русский язык Розенберга Е. Л., Коппель С. И. — М.: Мир, 1976. — 544 с.
- (недоступная ссылка). Дата обращения 16 августа 2011.
- (недоступная ссылка).
- ↑
Производители аммиака
Производители аммиака в России
| Компания | 2006, тыс. т | 2007, тыс. т |
|---|---|---|
| ОАО «Тольяттиазот» | 2634 | 2 403,3 |
| ОАО НАК «Азот» | 1526 | 1 514,8 |
| ОАО «Акрон» | 1526 | 1 114,2 |
| ОАО «Невинномысский азот», г. Невинномысск | 1065 | 1 087,2 |
| ОАО «Минудобрения» (г. Россошь) | 959 | 986,2 |
| ОАО «АЗОТ» г. Кемерово | 854 | 957,3 |
| ОАО «Азот»[прояснить] | 869 | 920,1 |
| ОАО «ЗМУ КЧХК» | 956 | 881,1 |
| ОАО Череповецкий «Азот» | 936,1 | 790,6 |
| ЗАО «Куйбышевазот» | 506 | 570,4 |
| ОАО «Газпром Нефтехим Салават» | 492 | 512,8 |
| «Минеральные удобрения» (г. Пермь) | 437 | 474,6 |
| ОАО «Дорогобуж» | 444 | 473,9 |
| ОАО «Воскресенские минеральные удобрения» | 175 | 205,3 |
| ОАО «Щекиноазот» | 58 | 61,1 |
| — | — | |
| Итого | 13 437,1 | 12 952,9 |
На долю России приходится около 9 % мирового выпуска аммиака. Россия — один из крупнейших мировых экспортёров аммиака. На экспорт поставляется около 25 % от общего объёма производства аммиака, что составляет около 16 % мирового экспорта.
По итогам 2014 года в России было произведено 14,8 млн тонн аммиака (+2 % к 2013 году) (по данным Росстата). Производство аммиака в России сконцентрировано в Приволжском федеральном округе (46 % по итогам 2014 года). Далее следуют Центральный федеральный округ (23 %) и Северо-Западный федеральный округ (16 %).
Порядка 25 % российского производства аммиака отправляется на экспорт. Так, в 2014 году объём российского экспорта аммиака (по данным ФТС) составил 3,6 млн тонн (+6 % к 2013 году) на сумму 1,6 млрд долл. США.
Ключевыми странами-получателями в 2014 году стали Украина, Финляндия и Литва.
Производители аммиака на Украине[источник не указан 324 дня]
| Компания | 2008 |
|---|---|
| ПАО «Концерн Стирол» | 1331 |
| Одесский припортовый завод | 1128 |
| Северодонецкое объединение Азот | 1015 |
| «Азот» (Черкассы) | 778 |
| «Днепроазот» | 515 |
| «Ровноазот» | 382 |
| Итого | 5149 |