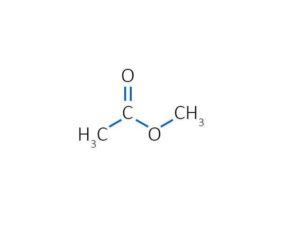
Метилацетат (метиловый эфир уксусной кислоты)
Содержание:
Примечания
- ↑
- ↑ CRC Handbook of Chemistry and Physics (англ.)
- ↑ CRC Handbook of Chemistry and Physics (англ.)
- ↑ CRC Handbook of Chemistry and Physics (англ.)
- ↑ CRC Handbook of Chemistry and Physics (англ.)
- CRC Handbook of Chemistry and Physics (англ.)
- CRC Handbook of Chemistry and Physics (англ.)
- Меньщиков В. А., Семенов И. П. Разработка процесса получения этилацетата дегидрированием этанола // Катализ в промышленности, № 5, 2012. — с. 32-36.
- Присяжнюк 3. П. // Этилацетат (рус.) / ред. И. Л. Кнунянц и Н. С. Зефиров. — Химическая энциклопедия. — Москва: Советская энциклопедия, 1998. — Т. 5. Триптофан — Ятрохимия. — С. 494. — 783 с. — ISBN 5-85270-310-9.
- Органикум. Том 2. Москва, Мир, 1992, с. 180.
Где купить Метилацетат в Москве: наши преимущества
Профессиональное консультирование опытными специалистами дополняется другими преимуществами покупки Метилацетата в HIMTEX. Обращаясь к нам, Вы получаете такие привлекательные условия, как:
- минимальная на современном рынке стоимость Метилацетата;
- гарантированное качество продукции от лучших производителей;
- индивидуальный подход ко всем оптовым покупателям CH3COOCH3;
- бесплатная доставка по Москве и низкая стоимость доставки по России.
Выбирая Химтэкс с целью купить Метилацетат оптом, Вы отдаете предпочтение надежной компании, занимающейся продажей органических растворителей с 2007 года. Мы не только предложим Вам качественный товар, но и обеспечим всей необходимой документацией, включая сертификаты и налоговые документы.
Аминокислоты
Соединения, имеющие в своей структуре одновременно две функциональные группы – амино NH2 и карбоксильную – COOH. Например,
NH2-CH2-COOH
Предельные аминокислоты с одной карбоксильной и одной аминогруппой изомерны соответствующим предельными нитросоединениям т.е. как и они имеют общую молекулярную формулу CnH2n+1NO2
В заданиях ЕГЭ на классификацию органических веществ важно уметь записывать общие молекулярные формулы гомологических рядов разных типов соединений, зная особенности строения углеродного скелета и наличия тех или иных функциональных групп. Для того, чтобы научиться определять общие молекулярные формулы органических соединений разных классов, будет полезен материал по этой теме
Физические свойства ацетилена:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 1,0896 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 1,173 |
| Температура плавления, °C | -80,8 |
| Температура кипения, °C | -80,55 |
| Тройная точка, °C | 335 |
| Температура самовоспламенения, °C | 335 |
| Давление самовоспламенения, МПа | 0,14-0,16 |
| Критическая температура*, °C | 35,94 |
| Критическое давление, МПа | 6,26 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,1 до 100 |
| Удельная теплота сгорания, МДж/кг | 56,9 |
| Температура пламени, °C | 3150-3200 |
| Молярная масса, г/моль | 26,038 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Метилацетат
Метилацетат огнеопасен, и его пары образуют взрывчатые смеси с воздухом при комнатной температуре. Высокие концентрации его паров могут вызвать раздражение глаз и слизистых оболочек. Воздействие паров этого соединения может также приводить к головным болям, сонливости, головокружению, ощущению жжения в глазах и слезотечению, сильному сердцебиению, а также к чувству стеснения в груди и одышке.
Метилацетат ( метиловый эфир уксусной кислоты) отечест венного производства выпускается промышленностью в виде растворителя, в котором содержится 50 % ( масс.) основного продукта.
Метилацетат, кроме получения этерификацией, образуется в виде побочного продукта при производстве поливинилового спирта. По растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель, однако он обладает большей токсичностью.
Метилацетат технический-прозрачная, легкоподвижная, огнеопасная жидкость, состоящая в главной массе из уксуснометило-вого эфира ( СН3СООСН3) с примесью метилового спирта и ацетона.
Метилацетат образуется в основном из уксусной кисло-ты используемой в качестве растворителя. В незначительных количествах его образование возможно из ацетальдегида, используемого в качестве промотора, или же из солей металлов жирных алифатических кислот, вводимых в процесс в качестве катализатора.
Метилацетат — наркотик, при хроническом воздействии вызывает головную боль, сердцебиение, слезотечение.
Метилацетат гидролизуется примерно в 1 М растворе НС1 при 25 С.
Метилацетат ( СН3СООСН3), или уксуснометиловый эфир, получается взаимодействием уксусной кислоты и метилового спирта.
|
Технологическая схема синтеза и выделения уксусной кислоты из окиси углерода и метилового спирта. |
Метилацетат и диметиловый эфир в условиях реакции при достаточном количестве воды гидролизуются, давая метиловый спирт. Поэтому их возвращают в процесс. Общее же количество побочных продуктов невелико и составляет 4 кг жидких продуктов на 100 кг уксусной кислоты, причем 2 кг приходится на пропионовую кислоту.
Метилацетат ( уксуснометиловый эфир) — бесцветная прозрачная жидкость со слабым запахом, смешивается с водой в соотношении 1: 3; уд.
Метилацетат 259 Метилгексилкетон 259 Метилен хлористый 261 Метиловый спирт 260 Метилпропилкетон 259 Метилсистокс 259 Метилфторфенилдихлорсилан 263 Метилэтилкетон 259 Микроаспираторы 18 ел.
Метилацетат полностью омы-ляется в организме, образуя метиловый спирт и уксусную кислоту. Расщепляется медленнее, чем другие сложные эфиры уксусной кислоты.
Горящий метилацетат рекомендуется тушить водяным паром, негорючими газами, а разлившуюся жидкость — песком и покрывалами.
|
Области непрерывной четкой ректификации в системе метилацетат-метанол — бута-нол-1 — бутилацетат. |
Применение
Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель полиуретана, нитроцеллюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450—500 тысяч тонн, в 2014 год — около 3,5 млн тонн в год.
Один из самых популярных ядов, применяемых в энтомологических морилках для умертвления насекомых[источник не указан 957 дней]. Насекомые после умертвления в его парах гораздо мягче и податливее в препарировании, чем после умерщвления в парах хлороформа.
Обладая фруктовым запахом применяется как компонент фруктовых эссенций. Зарегистрирован в качестве пищевой добавки E1504 (ароматизатор). Добавляется в состав водок (либо образуется при реакции содержащегося в них этилового спирта с добавляемыми уксусной кислотой или уксуснокислыми солями) для смягчения запаха и вкуса спирта.
Лабораторное применение
Этилацетат часто используется для экстракции, а также для колоночной и тонкослойной хроматографии. Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации.
Используется для получения ацетоуксусного эфира::
- 2CH3COOC2H5→CH3COCH2COOC2H5+C2H5OH{\displaystyle {\mathsf {2CH_{3}COOC_{2}H_{5}\rightarrow CH_{3}COCH_{2}COOC_{2}H_{5}+C_{2}H_{5}OH}}}
Охрана труда
Предельно-допустимая концентрация этилацетата в воздухе рабочей зоны составляет 50 мг/м3 (среднесменная, за 8 часов) и 200 мг/м3 (максимально-разовая). Но по данным порог восприятия запаха в группе людей (среднее значение) может достигать, например, 1120 мг/м³. А у отдельных людей он может быть значительно больше среднего значения. По этой причине можно ожидать, что использование широко распространённых в сочетании с «заменой по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками) приведёт к чрезмерному воздействию паров этилацетата на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от этилацетата следует использовать более эффективные изменение технологии и средства коллективной защиты.
ЛД50 для крыс составляет 11,6 г/кг, показывая низкую токсичность. Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей, при действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м³. ПДК в атмосферном воздухе населенных мест 0,1 мг/м³.
Температура вспышки — 2 °C, температура самовоспламенения — 400 °C, концентрационные пределы взрыва паров в воздухе 2,1—16,8 % (по объёму).
Безопасность при транспортировке: в соответствии с ДОПОГ (ADR) класс опасности 3, код по реестру ООН 1173.
Где применяют этилацетат
Этилацетат – это этиловый этер этановой кислоты в виде горючего не имеющего цвета летучего жидкого вещества, обладающего резким запахом фруктов. Механические примеси отсутствуют. Это в меру полярный растворяющий продукт со свойствами эстеров.
Растворению поддается в метилкарбиноле, этиловом эфире, бензоле, метилтрихлориде, метилбензоле и некоторых иных органических растворителях. Что касается воды, то в ней растворение более слабое.
Сам же растворяюще действует на эфиры целлюлозы, смоляные лаки на масляной основе, жиры и воски.
Молярная масса – 88,11 г/моль, плотность – 0,902 г/см³. Термосвойства: t плавления – -83 °C, t кипения – 77 °C. Формула: C4H8O2.
Получение в пром. масштабах происходит в ходе реакции этанола и уксусной кислоты. Также возможна обработка этанола с помощью карбометилена или синтез из уксусного альдегида при наличии катализатора алкоксида алюминия.
Применение этилацетата
роль данного вещества – растворяющая (на это уходит треть всего выпускаемого этилового эфира этановой кислоты). Ему отдают предпочтение среди других растворителей, ввиду невысокой цены, малотоксичности и вполне сносного запаха.
С его помощью растворяют нитро- и ацетилцеллюлозу, воски и жиры, нитроглифталевые, перхлорвиниловые, эпоксидные, полиэфирные, кремнийорганические лаки, краски, эмали, а также очищают печатные платы.
Так, он задействуется в изготовлении ЛК материалов, клеевых композиций и чернил для печатной техники. При упаковке товара с помощью всяческих гибких паковальных материалов берется для растворения в ходе трафаретного нанесения надписей и рисунков.
В совокупности со спиртом этилацетат как растворитель используют, кроме всего прочего, при изготовлении искусственной кожи.
Это, к тому же, популярнейший ядохимикат. Он входит в состав энтомологических морилок (задача – умерщвлять насекомых). Если сравнивать с тем же хлороформом, который применяется с аналогичной целью, этилацетат более размягчает объект воздействия и делает его податливее в препарировании.
Используется данное вещество ввиду низкотоксичности и в качестве составляющей фруктовых эссенций. Это известная добавка к пище E1504. Ее вносят в охлаждающие напитки, ликеры и различную кондитерку. С ее помощью из кофе экстрагируют кофеин.
В лабораторной практике находит применение в экстракции для вытягивания орган. веществ из водных растворов и хроматографии (колоночной и тонкослойной). Иногда выступает растворителем в некоторых хим. реакциях. Редкость такого использования объясняется склонностью к сольволизу водой и переэтерефикации.
Фармацевты применяют его как реакционную среду для изготовления ряда препаратов: метоксазола, гидрокортизона, рифампицин и др.
При создании взрывчатки выступает желатинизатором. В электронной отрасли, при создании алюминиевой фольги и тонких листков алюминия – очистителем и обеззараживателем. Задействуется и в создании фото-, кинопленок, целлофана, всяческих тех. изделий из резины.
Этилацетат в промышленности
Этилацетат, или эфир этановой кислоты, находит широкое применение в разных пром. отраслях, выполняя большой перечень задач:
– в лакокрасочном, клеевом, целлюлозном производстве и изготовлении искусственной кожи, чернил для печатных машинок выступает растворителем. Также растворяющее действует при нанесении чернильных рисунков и надписей на упаковочные материалы;
– в фармацевтической отрасли служит реагентом и реакционной средой при изготовлении лекарств;
– в создании алюминиевой фольги и тонких листов алюминия – обезжиривателем;
– в электронной промышленности также используется для обезжиривания, а еще для очищения;
– в пищепроме это популярный экстрагент (к примеру, помогает экстрагировать кофеин из кофе). Кроме того, его задействуют при создании охлаждающих напитков, ликеров, кондитерки и фруктовых эссенций;
– в производстве взрывчатки – желатинизатор;
– в косметической промышленности его вводят в состав средств для маникюра, в частности для снятия лакового покрытия с ногтей.
Такая широта применения обусловлена относительной недороговизной, низкотоксичностью и эффективностью в каждом из вышеперечисленных процессов.
Благодаря высокой эффективности и функционализму, с учетом незначительной токсичности, этилацетат и получил столь широкое применение.
Химические свойства
По химическим свойствам метилацетат представляет собой типичный сложный эфир алифатической монокарбоновой кислоты.
Легко гидролизуется (омыляется) на исходные спирт и кислоту водой (обратимо) или щелочами (необратимо, так как образующаяся карбоновая кислота превращается в соль):
- CH3COOCH3+H2O → CH3COOH+CH3OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+H_{2}O\ \rightarrow \ CH_{3}COOH+CH_{3}OH} }
Восстановление метилацетата приводит к образованию двух спиртов (этанол и метанол):
- CH3COOCH3+2H2 → CH3CH2OH+CH3OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+2H_{2}\ \rightarrow \ CH_{3}CH_{2}OH+CH_{3}OH} }
Под действием аммиака метилацетат превращается в ацетамид и метанол:
- CH3COOCH3+NH3 → CH3CONH2+CH3OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+NH_{3}\ \rightarrow \ CH_{3}CONH_{2}+CH_{3}OH} }
Цепочки на спирты.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
ацетальдегид X1 X2 X3 X1 X4
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
ацетон X1 X2 X3 X1X4
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
глюкоза этанол этаналь этанол этилен этиленгликоль
Задание 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
н-бутиловый спирт бутен-1 бутанол-2 2-бромбутан бутен-2
уксусная кислота изопропилацетат
Задание №5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
синтез-газ CH4O X1 X2 X3 X4 C4H10O
Задание №6
Навеску неизвестного соединения массой 4,4 г сожгли в избытке кислорода, в результате чего в качестве продуктов сгорания образовались только углекислый газ объемом 5,6 л и вода массой 5,4 г. Определите молекулярную формулу данного соединения и его структуру, если известно, что его молекула содержит четвертичный атом углерода.
n(CO2) = V(CO2)/Vm = 5,6/22,4 = 0,25 моль, следовательно, n(C) = n(CO2) = 0,25 моль,
тогда, m(C) = n(C)⋅M(C) = 0,25⋅12 = 3 г,
n(H2O) = m(H2O)/M(H2O) = 5,4/18 = 0,3 моль, следовательно, n(H) = 2⋅n(H2O) = 2⋅0,3 = 0,6 моль,
тогда, m(H) = n(H)⋅M(H) = 0,6⋅1 = 0,6 г,
m(O) = m(в-ва) — m(C) — m(H) = 4,4 – 3 – 0,6 = 0,8 г,
n(O) = m(O)/M(O) = 0,8/16 = 0,05 моль,
n(С):n(H):n(O) = 0,25:0,6:0,05 = 5:12:1
Таким образом, простейшая формула искомого соединения C5H12O.
Предположим, что простейшая формула совпадает с истинной. Тогда, искомым веществом может являться какой-либо предельный нециклический одноатомный спирт. В условии сказано, что искомое вещество содержит четвертичный углеродный атом. Единственным подходящим веществом в таком случае является 2,2-диметилпропанол-1, структурная формула которого:
Задание №7
При сжигании 5,8 г неизвестного вещества в качестве продуктов сгорания образовались только вода и углекислый газ, масса которого составила 13,2 г. Определите молекулярную формулу вещества и его структуру, если известно, что оно содержит кислород с массовой долей 27,59%. При этом само вещество может быть получено в одну стадию из циклогексена.
n(CO2) = m(CO2)/M(CO2) = 13,2/44 = 0,3 моль, следовательно, n(C) = n(CO2) = 0,3 моль,
m(C) = n(C) ·M(C) = 0,3·12 = 3,6 г,
m(O) = m(в-ва)·w(O) = 5,8·0,2759 = 1,6 г,
n(O) = m(O)/M(O) = 1,6/16 = 0,1 моль,
m(H) = m(в-ва) – m(O) – m(C) = 5,8 – 1,6 – 3,6 = 0,6 г, следовательно,
n(H) = m(H)/M(H) = 0,6/1 = 0,6 моль,
n(С):n(H):n(O) = 0,3:0,6:0,1 = 3:6:1
Таким образом, простейшая формула искомого соединения C3H6O.
Соединений с такой истинной молекулярной формулой, которые могли бы быть получены в одну стадию из циклогексена не существует. Поэтому попробуем удвоить простейшую формулу. Получаем C6H12O2. Искомым соединением может быть циклогександиол-1,2 со структурной формулой:
Задание №8
Навеску неизвестного соединения массой 7,4 г сожгли в избытке кислорода. В результате сгорания данной порции вещества в качестве продуктов сгорания образовались только 8,96 л углекислого газа и 11,2 л паров воды (в пересчете на н.у.). Определите молекулярную формулу данного соединения и установите его строение, если известно, что оно реагирует с щелочными металлами, а также является устойчивым к окислению раствором перманганата калия.
n(CO2) = V(CO2)/Vm = 8,96/22,4 = 0,4 моль, следовательно, n(C) = n(CO2) = 0,4 моль,
тогда, m(C) = n(C)·M(C) = 0,4·12 = 4,8 г,
n(H2O) = V(H2O)/Vm = 11,2/22,4 = 0,5 моль, следовательно, n(H) = 2n(H2O) = 2·0,5 = 1 моль,
тогда, m(H) = n(H)·M(H) = 1·1 = 1 г,
m(O) = m(в-ва) — m(H) — m(С) = 7,4 – 1 – 4,8 = 1,6 г,
n(O) = m(O)/M(O) = 1,6/16 = 0,1 моль,
n(C):n(H):n(O) = 0,4:1:0,1 = 4:10:1
Таким образом, простейшая формула искомого органического вещества C4H10O.
Данная формула, очевидно, является также и истинной молекулярной, поскольку ее удвоение, утроение и т.д. приводит к невозможному для органического вещества составу молекулы.
Исходя из того, что искомое соединение является устойчивым к окислению раствором перманганата калия, можно заключить, что им является третбутиловый спирт:
Токсичность, охрана труда[править | править код]
Слабо раздражает слизистые оболочки глаз и дыхательных путей (при концентрации 15 мг/л химически чистого метилацетата для ощущения раздражения требуется 5-минутная экспозиция). В высоких концентрациях оказывает лёгкое наркотическое воздействие, — в основном, за счёт действия самого сложного эфира, и, в меньшей степени, — за счёт образующегося из него спирта.
При пероральном введении ЛД50 = 2,9 г/кг (белые крысы), 2,4 г/кг (мыши и кролики), 3,6 г/кг (морские свинки).
ПДК в атмосферном воздухе населенных мест 0,07 мг/м³.
По данным Роспотребнадзора, ПДК в воздухе рабочей зоны равна 100 мг/м3 (максимально-разовая). Однако по данным ряда исследований, порог восприятия запаха этого вещества может быть гораздо выше этой ПДК. Например, среднее значение порога в исследовании было 900 мг/м3; в 5250 мг/м3; а в 8628 мг/м3. Поэтому можно ожидать, что использование широко распространённых в сочетании с «заменой по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками СИЗОД) приведёт к чрезмерному воздействию паров метилацетата на, по крайней мере, часть работников — из-за несвоевременной замены противогазных фильтров. Для защиты от метилацетата следует использовать значительно более эффективные изменение технологии и средства коллективной защиты.
Сложные эфиры неорганических кислот
Основная статья: Сложные эфиры неорганических кислот
В сложных эфирах неорганических (минеральных) кислот углеводородный радикал (например, алкил) замещает один или несколько атомов водорода неорганической оксокислоты, таким образом эфиры неорганических кислот могут быть как средними, так и кислыми.
По строению эфиры напоминают соли кислот. Так, эфирами фосфорной, азотной, серной и др. кислот являются органические фосфаты, нитраты, и др. соответственно.
Ниже приведены примеры эфиров неорганических кислот:
| Кислота | Сложные эфиры | ||||
| Название | Формула | Название | Общая формула | Примеры | |
| Молекулярная | Структурная | ||||
| Фосфорная кислота | H3PO4 | Фосфорные эфиры(фосфаты) | (RO)nP(=O)(OH)3-n,где n = 1-3 |
(случай n = 3) |
|
| Азотная кислота | HNO3 | Нитратные эфиры(нитраты) | (RО)N(=O)O |
|
|
| Азотистая кислота | HNO2 | Нитритные эфиры(нитриты) | (RO)N(=O) |
|
|
| Серная кислота | H2SO4 | (R1O)S(=O)2(OR2) | |||
| Сернистая кислота | H2SO3 | Сульфитные эфиры(сульфиты) | (R1O)S(=O)(OR2) | ||
| Угольная кислота | H2CO3 | Угольные эфиры(карбонаты) | (R1O)C(=O)(OR2) |
|
|
| Борная кислота | H3BO3 | Борные эфиры(бораты) | (RO)3B |
|
В таблице, в эфиров символом =О обозначена оксогруппа.
Получение
Метилацетат получают:
этерификацией уксусной кислоты метанолом в жидкой фазе в присутствии серной кислоты (или при пропускании смеси паров указанных жидкостей над нагретыми катализаторами: FeCl3, AlCl3):
- CH3COOH+CH3OH → CH3COOCH3+H2O{\displaystyle \mathrm {CH_{3}COOH+CH_{3}OH\ \rightarrow \ CH_{3}COOCH_{3}+H_{2}O} }
из уксусного ангидрида и метанола (реакция протекает в жидкой фазе в отсутствии катализатора и является практически необратимой):
- (CH3CO)2O+CH3OH → CH3COOCH3+CH3COOH{\displaystyle \mathrm {(CH_{3}CO)_{2}O+CH_{3}OH\ \rightarrow \ CH_{3}COOCH_{3}+CH_{3}COOH} },
по реакции Байера-Виллигера воздействием перкарбоновой кислоты на на ацетон в присутствии кислот Льюиса как катализатора (например, BF₃):
- (CH3)2CO+RC(O)OOH →H+ CH3COOCH3{\displaystyle \mathrm {(CH_{3})_{2}CO+RC(O)OOH\ {\xrightarrow {H^{+}}}\ CH_{3}COOCH_{3}} },
кроме синтетических методов — пиролизом древесины.
Метилацетат оптом от HIMTEX: наш ассортимент
Приобретая данную разновидность органического растворителя в нашей компании, Вы можете выбрать любой вид фасовки. В нашем ассортименте представлены полиэтиленовые канистры емкостью от 1 до 20 литров, а также ж/б вместимостью 200 литров. Выбор оптимального для Вас варианта, прежде всего, зависит от целей приобретения.
Если Вы планируете использовать продукт для лабораторных химических исследований, подойдут п/э канистры с минимальной емкостью. Для мелких строительно-ремонтных работ или небольших автомастерских — 10- или 20-ти литровые канистры. Что касается производственного применения в крупных объемах, то здесь оптимальным решением станут 200-литровые емкости с Метилацетатом. Так или иначе, но в Вашем распоряжении всегда находятся бесплатные услуги наших консультантов. Опытные специалисты помогут выбрать подходящий вариант из предложенного в каталоге ассортимента.
Где купить Метилацетат в Москве: наши преимущества
Профессиональное консультирование опытными специалистами дополняется другими преимуществами покупки Метилацетата в HIMTEX. Обращаясь к нам, Вы получаете такие привлекательные условия, как:
- минимальная на современном рынке стоимость Метилацетата;
- гарантированное качество продукции от лучших производителей;
- индивидуальный подход ко всем оптовым покупателям CH3COOCH3;
- бесплатная доставка по Москве и низкая стоимость доставки по России.
Выбирая Химтэкс с целью купить Метилацетат оптом, Вы отдаете предпочтение надежной компании, занимающейся продажей органических растворителей с 2007 года. Мы не только предложим Вам качественный товар, но и обеспечим всей необходимой документацией, включая сертификаты и налоговые документы.
Технические характеристики:
Внешний вид
Прозрачная жидкость без механических примесей, допускается слабожелтое окрашивание
| Высший сорт | Первый сорт | |
|---|---|---|
| 99,5 | 99,0 | |
| 0,3 | 0,7 | |
| 0,02 | 0,03 | |
| 0,2 | 0,3 |
ООО «ХИМТЭКС», 129344, 141260, Московская область, Пушкинский район, рабочий поселок Правдинский, ул. Герцена д.30, корп.1, помещение 13, тел. 8 (499) 707-29-77
Василиса ЯВИКС — интеллектуальная поисковая система. Завтра уже здесь!
| метиловый эфир этановой кислоты |
| MeOAc |
| метиловый эфир уксусной кислоты,уксуснометиловый эфир |
| C3H6O2 |
формула
CH3COOCH3
жидкость
74.08 г/моль
0.9330 г/см³
0.
362 Па·с
10,27 ± 0,01 эВ
0,52 Ом·м
-98.1 °C
57.1 °C
-9.4 °C
-10 °C
470 °C
3,15 — 15,60 %
233.70
156.19 Дж/(моль·К)
0,2224 атм
31,9 г/100 мл
1.
1.72±0.09 Д
79-20-9
6584
201-185-2
номер EC
607-021-00-X
AI9100000
77700
1231
6335
100 мг/м³
низкая
R11, R36, R66, R67
S16, S26, S29, S33
Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного.
Метилацета́т (метиловыйэфируксусной кислоты, метиловый эфир этановой кислоты, уксуснометиловый эфир, MeOAc) CH3COOCH3 — органическое вещество класса сложных эфиров.
Встречается в природе, большей частью в эфирных маслах растений (например, до 8,9 % в различных видах мяты, до 28,2 % в лабазнике, до 44 % в жасмине), и в пищевых продуктах (например, в коньяках многолетней выдержки).
Физические свойства
Бесцветная прозрачная жидкость с фруктовым запахом.
Хорошо смешивается с органическими растворителями. По растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель. Смешивается в любых соотношениях с этанолом и этиловым эфиром, хорошо растворим в ацетоне и хлороформе, растворим в бензоле.
Некоторые свойства отличаются по разным источникам: плотность 0,9330 и 0,9244г/см3; показатель преломления 1,3619 и 1,3593; динамическая вязкость 0,362 и 0,381.
Растворимость в воде 31,9 %, образует с водой азеотропную смесь (температура кипения 56,4 °C, 96,7 % метилацетата). Образует азеотропные смеси с метанолом (температура кипения 54 °C, 81 % метилацетата) и ацетоном (температура кипения 56,1 °C, 45 % метилацетата).
Образует аддукты: метилацетат•SbCl5, метилацетат•HSbCl6 и метилацетат•BF3, плавящиеся, соответственно, при 87-88, 81-82 и 65,5 °С.
Взрывоопасные концентрации в смеси с воздухом 3,15 — 15,60 %.
Химические свойства
По химическим свойствам метилацетат представляет собой типичный сложный эфир алифатическоймонокарбоновой кислоты.
Легко гидролизуется (омыляется) на исходные спирт и кислоту водой (обратимо) или щелочами (необратимо, так как образующаяся карбоновая кислота превращается в соль):
→
Восстановление метилацетата приводит к образованию двух спиртов (этанол и метанол):
→
Под действием аммиака метилацетат превращается в ацетамид и метанол:
→
Получение
Метилацетат получают:
→
из уксусного ангидрида и метанола (реакция протекает в жидкой фазе в отсутствии катализатора и является практически необратимой):
→, ,
кроме синтетических методов — пиролизом древесины.
Применение
Метилацетат применяют, в основном, в качестве растворителя в производстве лакокрасочных материалов и как компонент многих промышленных и бытовых растворителей. Является составной частью (7-75 %) лесохимических растворителей.
Используется при производстве клеев, композиционных лаков, шпатлевок, магнитных лент, автокосметики, эфиров целлюлозы, поливинилацетата, полиметилметакрилата, растительных и животных жиров, многих синтетических смол.
Применяется как экстрагент в аналитической химии, в том числе для отделения LiCl от хлоридов других щелочных металлов.
Метилацетат является ценным компонентом для промышленного синтеза, в том числе — из него карбонилированием получают уксусный ангидрид (процесс Реппеruen):
Используется в пищевой промышленности в качестве ароматизатора и экстрактивного растворителя в процессе декофеинизирования чая и кофе. В качестве ароматизатора и растворителя также входит в состав ряда косметических средств.
Токсичность
Слабо раздражает слизистые оболочки глаз и дыхательных путей (при концентрации 15 мг/л химически чистого метилацетата для ощущения раздражения требуется 5-минутная экспозиция). В высоких концентрациях оказывает лёгкое наркотическое воздействие, — в основном, за счёт действия самого сложного эфира, и, в меньшей степени, — за счёт образующегося из него спирта.
При пероральном введении ЛД50 = 2,9 г/кг (белые крысы), 2,4 г/кг (мыши и кролики), 3,6 г/кг (морские свинки).
ПДК в воздухе рабочих зон 100 мг/м³. ПДК в атмосферном воздухе населенных мест 0,07 мг/м³.
Литература
- Фридман Р.А. Парфюмерия. — М., 1955;
- Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — второй изд. — Х., 2007;
- Giordano F., Gazzaniga A., Moyano J.R. et al. Crystal forms ot piroxicam pivalate: preparation and characterization of two polymorphs // J. Pharm. Sci. — 1998. — № 87 (3);
- Pillai O., Nair V., Panchagnula R. Transdermal iontophoresis of insulin: IV. Influence of chemical enhancers // Int. J. Pharm. — 2004. — № 269 (1);
- Romero S., Escalera B., Bustamante P. Solubility behavior of polymorphs I and II of mefenamic acid in solvent mixtures // Int. J. Pharm. — 1999. — № 178.
Примечания
- Мяделец М. А., Домрачев Д. В., Черемушкина В. А. . Дата обращения 28 февраля 2016.
- . Дата обращения 28 февраля 2016.
- Зыкова И. Д., Ефремов А. А. . Дата обращения 28 февраля 2016.
- Горяев М. И. . Дата обращения 28 февраля 2016.
- Урсул О. Н., Алексанян К. А., Ткачук Л. А. . журнал «Пищевая промышленность: наука и технологии», Минск, ISSN 2073-4794 (1 ноября 2012). Дата обращения 28 февраля 2016.
- ↑ , с. 107.
- ↑ , с. 186.
- ↑ , с. 155.
- Козлов П.В., Герц И.Б. . М., «Искусство» (1965). Дата обращения 28 февраля 2016.
- «Кинетика щелочного гидролиза метилацетата, бутилацетата и изобутилацетата в растворах вода-ацетонитрил» / М. Ю. Панов, О. Б. Соколова // Журнал физической химии . — 15/07/1997 . — Т. 71, N 7 . — 1199—1203
- Менделеев Д. И., Монастырский Д. Н. Эфиры сложные // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Павлов Б.А., Терентьев А.П. . М., «Химия» (1965). Дата обращения 28 февраля 2016.
- . Дата обращения 28 февраля 2016.
- ↑ , с. 107-108.
- ↑ , с. 108.
- , p. 244.
- . Москва (15.06.2003 с изменениями от 26.05.2008). Дата обращения 28 февраля 2016.
- . БГУ. Дата обращения 28 февраля 2016. (недоступная ссылка)
- . Дата обращения 28 февраля 2016.