Из чего делают медицинский спирт? спирт этиловый: технология производства, состав и назначение
Содержание:
Технология производства метанола
Технология по производству спиртового химического вещества в домашних условиях может состоять из нескольких этапов.
https://youtube.com/watch?v=k3RCHtEL0UQ
Ниже представляются самые основные:
- Производство метанола с помощью солода. Зерна культурных растений необходимо проращивать в небольших посудинах, при этом их рассыпают в один слой, примерно до трех сантиметров. Помните, что предварительно пророщенные зерна необходимо обработать раствором марганцовки. После обработки семена помещаются в емкость и смачиваются водой. Следует учитывать, что наличие солнечных лучей, или достаточность света напрямую зависит от скорости прорастания зерна. Поверх емкости следует накрыть полиэтиленовый материал или тонкое стекло, то есть он должен быть достаточно прозрачным. Если наблюдается уменьшение количества воды, ее необходимо добавлять.
- Следующий этап: обработка крахмала. Для начала добываем крахмал из продукта, который выбран для изготовления этанола. В данном случае это картофель. Слегка порченый картофель необходимо варить до тех пор, пока из воды начнет образовываться клейстер. Далее ждем, пока продукт остынет, тем временем измельчаем солод. Следом перемешиваем два продукта. Далее происходит процедура расщепления крахмала, ее необходимо производить при температуре не менее 60 ˚ С. Теперь смесь помещается в посуду с горячей водой и оставляется на 1 час. По истечении времени изделие полностью остужают.
- Этап брожения. Как известно, брожение характеризуется присутствием в алкоголе содержащих элементов. Однако брагу назвать алкогольным напитком невозможно. После остывания смеси добавляются дрожжи, которые способны вступить в реакцию даже при комнатной температуре. Однако если температура поднимается выше — брожение продукта естественно будет происходить быстрее. При значительной жаре процедура брожения закончится по истечении трех суток. При этом из продукта можно ощущать мягкий запах зерна.
- Следующий этап — это перегонка. С помощью чего она производится? Для этого используется специальный аппарат для производства спирта в домашних условиях.
- Заключительным этапом считается технология очистки. Можно сказать, что метиловый спирт готов, но замечается, что жидкость не прозрачная. Именно поэтому и делается очистка. Она проводится путем добавления раствора марганцовки. В таком виде оставляем метиловый спирт на одни сутки, затем фильтруем — продукт готов.
Как, видим, технология изготовления домашнего спирта довольно проста и не требует дополнительных усилий.
https://youtube.com/watch?v=oTjgavoeyqc
Производство спирта из сульфитных щелоков
При производстве целлюлозы из древесины по сульфитному способу в качестве отхода получают сульфитный щелок — коричневую жидкость с запахом сернистого газа. Химический состав сульфитного щелока (%): вода — 90, сухие вещества — 10, в том числе производные лигнина — лигносульфонаты — 6, гексозы — 2, пентозы -1 , летучие кислоты, фурфурол и другие вещества — около 1. Длительное время сульфитные щелока спускали в реки, они загрязняли воду и уничтожали рыбу в водоемах. В настоящее время у нас имеется ряд заводов по комплексной переработке сульфитного щелока на этиловый спирт, кормовые дрожжи и сульфитно-бардяные концентраты. Производство спирта из сульфитных щелоков состоит из следующих стадий: подготовка сульфитного щелока к брожению, сбраживание сульфитнощелокового сусла, перегонка зрелой сульфитной бражки.
Подготовку сульфитного щелока к сбраживанию осуществляют по непрерывной схеме. Щелок продувают воздухом для удаления летучих кислот и фурфурола, задерживающих процесс брожения. Продутый щелок нейтрализуют известковым молоком и затем выдерживают для укрупнения выпавших кристаллов сернокислого и сернистокислого кальция; при этом добавляют питательные соли для дрожжей (сернокислый аммоний и суперфосфат). Затем щелок отстаивают. Осевший осадок- шлам — спускают в канализацию, а осветленный щелок охлаждают до 30-32°С. Подготовленный таким образом щелок называется суслом. Сусло направляют в бродильное отделение и сбраживают так же, как гидролизаты древесины, или применяют метод с подвижной насадкой. Подвижной насадкой называются волокна целлюлозы, остающиеся в щелоке. Метод брожения с подвижной насадкой основан на свойстве некоторых рас дрожжей сорбироваться на поверхности целлюлозных волокон и образовывать хлопья волокнисто-дрожжевой массы, которая в зрелой бражке быстро и полно оседает на дно чана. Брожение проводят в бродильной батарее, которая состоит из головного и хвостового чанов. В бродящем сусле волокна целлюлозы с сорбированными дрожжами находятся в непрерывном движении под влиянием выделяющегося углекислого газа. Отбродившая бражка поступает из головного чана в хвостовой, где заканчивается процесс брожения, и волокна с дрожжами оседают на дно. Осевшую дрожжеволокнистую массу насосом возвращают в головной чан, куда одновременно подают сусло, а зрелую бражку, содержащую 0,5-1% спирта, направляют в брагоректификационный аппарат и получают этиловый спирт, метиловый спирт и сивушное масло. Полученная после перегонки барда содержит пентозы и служит питательной средой для выращивания кормовых дрожжей, которые затем отделяют, высушивают и выпускают в виде сухих дрожжей. Барду после отделения дрожжей, содержащую лигносульфонаты, упаривают до содержания сухих веществ 50-80%. Полученный продукт называется сульфитно-бардяным концентратом и применяется в производстве пластических масс, строительных материалов, синтетических дубителей для получения кожи, в литейном производстве и дорожном строительстве.
Из сульфитно-бардяных концентратов можно получить ценное ароматическое вещество — ванилин.
Технологическая схема комплексной переработки сульфитных щелоков на этиловый спирт, кормовые дрожжи и сульфитно-бардяные концентраты показана на рисунке 2.
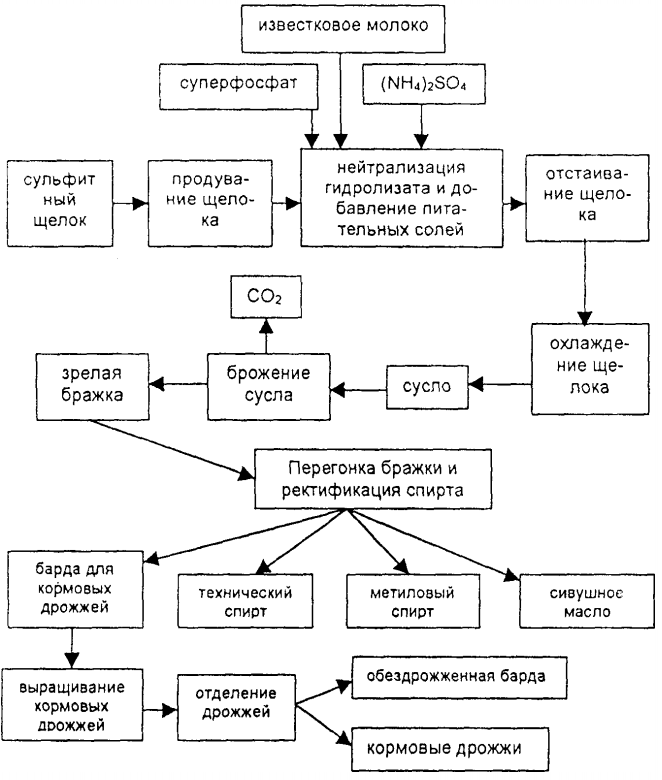
При переработке сульфитных щелоков получают в пересчете на 1т еловой древесины:
- Спирта этилового, л ……………….. 30-50
- Спирта метилового, л …………………… 1
- Жидкой углекислоты, л ………….. 19-25
- Сухих кормовых дрожжей, кг …. 15
- Сульфитно-бардяных концентратов влажностью 20%, кг …. 475
Биоэтанол из растительной биомассы
Биоэтанол — это этиловый спирт, полученный путем ферментации из сахаров с помощью микроорганизмов. Обычно для этой цели используют дрожжи (Saccharomyces cerevisiae). Сахар поступает из растений, которые используют энергию солнечного света в процессе фотосинтеза для создания своих органических компонентов из углекислого газа (СО2). Сахара могут храниться в форме крахмала (например у зерновых, картофеля) или сахарозы (например у сахарной свеклы, сахарного тростника), или они могут быть включены в структурные компоненты растений (например, целлюлоза).), которые придают растению его форму и устойчивость. В настоящее время биоэтанол в основном получают путем сбраживания сахарозы (бразильский сахарный тростник) или гидролизатов крахмала (кукуруза, другие злаки). После перегонки и сушки этанол можно использовать в качестве топлива. Однако этот вид технической культуры создает конкуренцию с продовольственным рынком. Кроме того, ограниченные доступные площади и экологические проблемы, связанные с необходимой интенсификацией сельского хозяйства, препятствуют крупномасштабному производству этанола на основе крахмала. Таким образом, целью ученых является все более широкое использование дешевых растительных остатков, таких как солома, древесные отходы и, или энергетических культур, таких как Просо прутьевидное (Panicum virgatum) или мискантус, которые не требуют интенсивного ведения сельского хозяйства и зачастую растут на бросовых угодьях.
Растительные остатки или энергетические культуры содержат мало крахмала или сахарозы, но содержат углеводы, хранящиеся в виде лигноцеллюлоз в клеточных стенках. Лигноцеллюлозы состоят из целлюлозы, гемицеллюлозы и неферментируемого лигнина («древесная масса»). Целлюлоза, как и крахмал, представляет собой полимер из шестиуглеродных молекул сахара, глюкозы, связанных между собой длинными цепями. Оба отличаются только типом связей. Гемицеллюлозы в основном состоят из пятиуглеродных сахаров, ксилозы и арабинозы которые соседствуют в разветвленных цепях.
Как традиционный этанол целлюлозный этанол может быть добавлен к бензину и использоваться во всех бензиновых автомобилях сегодня.
Его потенциал по снижению выбросов парниковых газов выше, чем у традиционного этанола, получаемого из зерновых. Производство целлюлозного этанола может стимулировать экономический рост в сельских районах, открыть новые рынки для фермеров и увеличить использование возобновляемых источников энергии.
Номенклатура спиртов
Спирты представляет собой органические соединения
гидроксильной (ОН) функциональной группы с алифатическим атомом
углерода. Поскольку ОН является принадлежностью молекул всех спиртов, их
часто представляют как производными воды с общей формулой ROH, где R
обозначает алкильную группу.
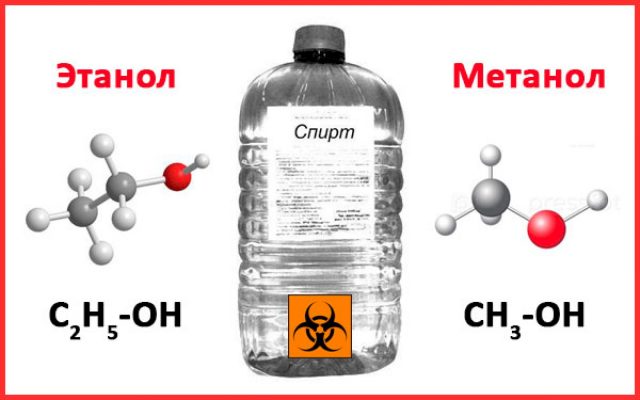
Получение спиртов метанола (СН3ОН) и этанола (СН3СН2ОН),
являющихся первыми двумя членами их гомологического ряда, является
важной задачей химической промышленности многих стран. При содержании от
одного до четырех атомов углерода их часто называют общими именами, в
которых за названием алкильной группы следует слово спирт:. Можно
видеть, что все четыре (две последние являются изомерами одного
вещества) представленные выше молекулы спиртов содержат одну
гидроксильную группу
По этому признаку все они относятся к классу
одноатомных спиртов (бывают и двух-, трех, четырех- и многоатомные). Кроме того, все они являются производными предельных углеводородов из
ряда алканов: метана, этана, пропана (названия спиртов получают
добавлением к названию алкена окончания «-ол»). Поэтому их еще называют
предельными одноатомными спиртами
Можно
видеть, что все четыре (две последние являются изомерами одного
вещества) представленные выше молекулы спиртов содержат одну
гидроксильную группу. По этому признаку все они относятся к классу
одноатомных спиртов (бывают и двух-, трех, четырех- и многоатомные).
Кроме того, все они являются производными предельных углеводородов из
ряда алканов: метана, этана, пропана (названия спиртов получают
добавлением к названию алкена окончания «-ол»). Поэтому их еще называют
предельными одноатомными спиртами.
Отстаивание разбавленного спирта
Во-первых, старайтесь заполнить емкость, в которой будет храниться спирт, по самое горлышко. Если спирт будет взаимодействовать с кислородом, то он окислится – образуется уксусная кислота. Разбавленный спирт можно использовать уже через пару дней, а лучше через неделю – за это время должны прекратиться все химические реакции. Оптимальная температура отстаивания – +40 С и выше, хранить емкость следует в темном месте.
После отстаивания спирта им можно смело заливать ингредиенты настоек, а после, если использовалось крепкое сырье, разбавить до нужных градусов руководствуясь таблицей, приведенной выше.
Теперь вы знаете, как разбавить спирт водой в домашних условиях, а значит, настойки и прочий домашний алкоголь стало готовить еще проще. Подписывайтесь на Ромовый дневник – это только толика полезной информации, которую мы хотим донести до вас. Удачи!
- https://therumdiary.ru/napitki/samogon/kak-pravilno-razvesti-spirt-vodoj-pryamo-u-sebya-na-kuxne.html
- http://drinkinhome.ru/raznye/kak-sdelat-spirt-v-domashnih-usloviyah/
- http://sunhi.ru/domashnee-proizvodstvo-spirta-prigotovlenie-spirta-v-domashnih-usloviyah/
- https://catarank.ru/v-domashnih-usloviyah/kak-sdelat-spirt-v-domashnih-usloviyah/
- https://catarank.ru/v-domashnih-usloviyah/kak-sdelat-spirt-v-domashnih-usloviyah/
Химические свойства спиртов.
Спирты отличаются разнообразными превращениями. Реакции спиртов имеют некоторые общие закономерности: реакционная способность первичных одноатомных спиртов выше, чем вторичных, в свою очередь, вторичные спирты химически более активны, чем третичные. Для двухатомных спиртов, в том случае, когда ОН-группы находятся у соседних атомов углерода, наблюдается повышенная (в сравнении с одноатомными спиртами) реакционная способность из-за взаимного влияния этих групп. Для спиртов возможны реакции, проходящие с разрывом как С–О, так и О–Н – связей.
1. Реакции, протекающие по связи О–Н.
При взаимодействии с активными металлами (Na, K, Mg, Al) спирты проявляют свойства слабых кислот и образуют соли, называемые алкоголятами или алкоксидами:
2CH3OH + 2Na 2CH3OK + H2
Алкоголяты химически не стабильны и при действии воды гидролизуются с образованием спирта и гидроксида металла:
C2H5OК + H2O C2H5OH + КOH
Эта реакция показывает, что спирты в сравнении с водой представляют собой более слабые кислоты (сильная кислота вытесняет слабую), кроме того, при взаимодействии с растворами щелочей спирты не образуют алкоголяты. Тем не менее, в многоатомных спиртах (в том случае, когда ОН-группы присоединены к соседним атомам С) кислотность спиртовых групп намного выше, и они могут образовывать алкоголяты не только при взаимодействии с металлами, но и со щелочами:
HO–CH2–CH2–OH + 2NaOH NaO–CH2–CH2–ONa + 2H2O
Когда в многоатомных спиртах НО-группы присоединены к не соседствующим атомам С, свойства спиртов близки к одноатомным, поскольку взаимовлияние НО-групп не проявляется.
При взаимодействии с минеральными или органическими кислотами спирты образуют сложные эфиры – соединения, содержащие фрагмент R–O–A (А – остаток кислоты). Образование сложных эфиров происходит и при взаимодействии спиртов с ангидридами и хлорангидридами карбоновых кислот (рис. 6).
При действии окислителей (К2Cr2O7, KMnO4) первичные спирты образуют альдегиды, а вторичные – кетоны (рис.7)
Рис. 7. ОБРАЗОВАНИЕ АЛЬДЕГИДОВ И КЕТОНОВ ПРИ ОКИСЛЕНИИ СПИРТОВ
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С, что молекула исходного спирта (рис.8).
Рис. 8. ВОССТАНОВЛЕНИЕ БУТАНОЛА
2. Реакции, протекающие по связи С–О.
В присутствии катализаторов или сильных минеральных кислот происходит дегидратация спиртов (отщепление воды), при этом реакция может идти в двух направлениях:
а) межмолекулярная дегидратация с участием двух молекул спирта, при этом связи С–О у одной из молекул разрываются, в результате образуются простые эфиры – соединения, содержащие фрагмент R–О–R (рис. 9А).
б) при внутримолекулярной дегидратации образуются алкены — углеводороды с двойной связью. Часто оба процесса – образование простого эфира и алкена – протекают параллельно (рис. 9Б).
В случае вторичных спиртов при образовании алкена возможны два направления реакции (рис. 9В), преимущественное направление то, при котором в процессе конденсации отщепляется водород от наименее гидрогенизированного атома углерода (отмечен цифрой 3), т.е. окруженного меньшим количеством атомов водорода (в сравнении с атомом 1). Показанные на рис. 10 реакции используют для получения алкенов и простых эфиров.
Разрыв связи С–О в спиртах происходит также при замещении ОН-группы галогеном, или аминогруппой (рис. 10).
Рис. 10. ЗАМЕНА ОН-ГРУППЫ В СПИРТАХ ГАЛОГЕНОМ ИЛИ АМИНОГРУППОЙ
Реакции, показанные на рис. 10, используют для получения галогенуглеводородов и аминов.
Гидролизный спирт
Промышленное использование ксилана организуется как самостоятельное производство для переработки растительного сырья67 72 или комбинируется с производством гидролизного спирта и целлюлозы. В последнем случае растительный материал подвергается предварительному гидролизу для удаления пентозанов с последующей их переработкой на фурфурол или ксилозу, а затем производится гидролиз целлюлозы до глюкозы с дальнейшей переработкой в спирт.
Хранение и использование в технологических целях — ( для очистки деталей или внутренних поверхностей камеры) гидролизного спирта, как легковоспламеняющейся жидкости, должно производиться в соответствии с требованиями раздела 1.4 настоящих Правил. Кроме того, гидролизный спирт содержит токсические примеси, которые могут вызвать отравление при приеме его внутрь, что должно найти отражение в производственных инструкциях и инструкциях по технике безопасности для работающих с этим спиртом.
Этиловый спирт, полученный из древесины в результате ее гидролитического расщепления и сбраживания сахаристых веществ, называют гидролизным спиртом.
За 5 — 10 мин до нанесения на склеиваемые поверхности клея их необходимо протереть ветошью, смоченной гидролизным спиртом. После испарения спирта на сухую поверхность трубы и накладки наносится деревянным шпателем слой клея толщиной 2 — 3 мм и сразу же накладывается накладка на трубу так, чтобы место утечки газа находилось напротив резьбового отверстия в центре накладки.
Исходные компоненты предварительно просушивали до постоянного веса при 160, измельчали в фарфоровой ступке и смешивали в гидролизном спирте.
В промышленности применяется этиловый спирт, полученный двумя путями: 1) спиртовым брожением продуктов гидролиза древесины ( гидролизный спирт), 2) гидратацией этилена по схеме С.
Для производства дивинила по способу С. В. Лебедева пригоден этиловый спирт любого происхождения: спирт брожения-спирт-сырец, синтетический этиловый спирт, гидролизный спирт и спирт из сульфитных щелоков.
Примерно 2 % — ный раствор индикатора щелочного голубого приготовляют растворением 2 г индикатора на холоду в 100 мл гидролизного спирта высшей очистки. После стояния в течение 24 ч нерастворимый остаток отфильтровывают, раствор индикатора переливают в колбу с притертой пробкой и хранят в темном месте.
При этом образуется глюкоза ( С6Н1005) П г дро — — С6Н1206, которую описанным выше способом превращают в гидролизный спирт.
Для приготовления 1 м3 водного раствора продукта АГМ-3 или АГМ-9 необходимо 5 — 10 л продукта предварительно разбавить двойным количеством гидролизного спирта и смесь влить в 1 м3 воды, подогретой до 80 — 90 С.
Окисление лигнинсодержащего сырья ( например, лигносульфатов — отхода в производстве древесной целлюлозы сульфитной варки, барды — отхода в производстве гидролизного спирта или дрожжей, древесных опилок и др.) в щелочной среде в присутствии оксидов Со, Си, Мп или других катализаторов; из смеси продуктов реакции ванилин экстрагируют бутанолом или бензолом и очищают гидросульфитной обработкой, перегонкой или кристаллизацией.
Получается при действии HaSO под давлением на подсолнечную или овсяную лузгу, кендырь; как побочный продукт в производстве бумаги и гидролизного спирта из древесины.
Гидролизная промышленность вырабатывает из непищевого растительного сырья ( древесины, хлопковой шелухи, подсолнечной лузги, соломы) такие вещества, как гидролизный спирт, белковые дрожжи, кристаллический сахар ( глюкозу и ксилозу), твердую двуокись углерода, метиловый спирт, фурфурол, лигнин и многие другие.
Получается при действии ШЗС под давлением на подсолнечную или овсяную лузгу, на кендырь и как побочный продукт в производстве бумаги и гидролизного спирта из древесины.
Получается при действии HsSC под давлением на подсолнечную или овсяную лузгу, на кендырь и как побочный продукт в производстве бумаги и гидролизного спирта из древесины.
Промышленное получение спирта
В первом случае опилки в вертикальном бункере заливаются концентрированным (40%) раствором серной кислоты. Массовые объемы опилок и раствора равны. Смесь герметично закрытого бункера доводят до температуры 220-250°С и регулярно перемешивая выдерживают от 1 ч до 1 ч 20 мин. Затем полученные при гидролизе растворы глюкозы и серной кислоты сцеживают. К слитой в другую емкость жидкости добавляют раствор мела для нейтрализации кислоты. Последующей фильтрацией отделяют раствор глюкозы от отходов.
Метод не стал распространенным из-за высокой стоимости и повышенных требований к материалу применяемого оборудования, который должен выдерживать агрессивное воздействие концентрированной серной кислоты.
При втором, менее затратном, способе применяется слабый (0,5-1,0%) раствор кислоты. Процесс протекает 1,2-1,5 ч при температурах 160-190°С и давлении в бункере до 15 атм.
Общие моменты для рассмотренных методов гидролиза:
- Рабочие емкости изнутри выкладывают кислотоупорным материалом для исключения контакта кислоты с металлом.
- Загруженные в бункеры вещества нагревают с помощью подачи внутрь горячего пара. Выпускным клапаном для пара регулируют внутреннее давление рабочей емкости.
- Гидролиз с успехом применяют для переработки опилок любых пород древесины.
- Полученная после химической реакции глюкоза используется для дальнейшего изготовления спирта, метанола, сахара.
- Рабочий процесс сопровождается выделением опасных газов. Для безопасности работников производственные помещения обязаны проветриваться, а сам персонал работает в специальных защитных респираторах и очках.
При производстве биотоплива из древесных опилок, получают побочные вещества, способные принести дополнительную прибыль:
- Лигнин – связующее вещество для получения пеллет и евродров из опилок и других измельченных материалов, активный наполнитель для пластмасс и синтетических каучуков.
- Фурфурол – жидкость, используемая как антисептик для древесины и компонент противогрибковых медикаментов. Также применяется для очистки масел и нефти, производства пластмасс, получения гербицидов, синтетических волокон и красителей. Другие свойства и перспективные варианты применения фурфурола изучаются.
- Скипидар.
- Алебастр.
Где используется продукт
Медицинский спирт применяется в качестве:
- Общего обезболивающего средства (при анестезии).
- Противомикробного и антисептического средства. Даже если будет применяться разбавленный спирт (примерно 20 %), он эффективно очистит кожные покровы от бактерий и вирусов. Но для получения максимального действия лучше брать медицинский спирт. Сколько градусов в нем должно быть? Лучше брать 70-градусный продукт. Используют вещество для обработки разных поверхностей в медицинских кабинетах и инструментов, чтобы добиться их стерильности.
- Базовой составляющей экстрактов, настоек, медикаментов, которые применяются наружно.
- Средства для оказания неотложной помощи вследствие интоксикации суррогатными алкогольными напитками.
- Согревающего и жаропонижающего средства. Из-за высокой испаряемости вещества спиртовое обтирание поверхности тела позволяет получить мощный охлаждающий эффект. Поэтому чистый спирт часто используют для снижения высокой температуры. А если энергично растираться спиртом, можно быстро согреть тело и организм.
- Хорошего противоотечного вещества. Если наложить на место отека компресс, пропитанный спиртом, быстро оттянется лишняя вода.
- Пеногасителя. Благодаря высококонцентрированному спиртовому раствору осуществляют искусственную вентиляцию легких. Когда в дыхательных путях скопилось много пенящей слизи, пострадавшему дают подышать чистым кислородом, который первым делом пропускается через этанол.
- Консерванта для длительного хранения анатомических составляющих.
Получение спиртов.
Некоторые из показанных выше реакций (рис. 6,9,10) обратимы и при изменении условий могут протекать в противоположном направлении, приводя к получению спиртов, например при гидролизе сложных эфиров и галогенуглеводородов (рис.11А и Б, соответственно), а также гидратацией алкенов – присоединением воды (рис.11В).
Рис. 11. ПОЛУЧЕНИЕ СПИРТОВ ГИДРОЛИЗОМ И ГИДРАТАЦИЕЙ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Реакция гидролиза алкенов (рис. 11, схема В) лежит в основе промышленного производства низших спиртов, содержащих до 4 атомов С.
Этанол образуется и при так называемом спиртовом брожении сахаров, например, глюкозы С6Н12О6. Процесс протекает в присутствии дрожжевых грибков и приводит к образованию этанола и СО2:
С6Н12О6 2С2Н5ОН + 2СО2
Брожением можно получить не более чем 15%-ный водный раствор спирта, поскольку при более высокой концентрации спирта дрожжевые грибки погибают. Растворы спирта более высокой концентрации получают перегонкой.
Метанол получают в промышленности восстановлением монооксида углерода при 400° С под давлением 20–30 МПа в присутствии катализатора, состоящего из оксидов меди, хрома, и алюминия:
СО + 2 Н2 Н3СОН
Если вместо гидролиза алкенов (рис. 11) проводить окисление, то образуются двухатомные спирты (рис. 12)
Рис. 12. ПОЛУЧЕНИЕ ДВУХАТОМНЫХ СПИРТОВ
Как получить спирт методом брожения
Винный или этиловый спирт можно получить разными химическими и биохимическими способами. Самым старым и распространенным методом является алкогольное брожение с последующей дегидратацией (удалением воды).
Довольно сложным является получение этилового спирта путем брожения, в котором участвуют дрожжи. Установлено, что брожение провоцируют не сами дрожжи, а выделяемые ими специфические вещества – зимазы. В процессе брожения глюкоза С6Н12О6 преобразуется в спирт и углекислоту по следующему уравнению:
С6Н12О6 → 2СО2 + 2С2Н5ОН + энергия
где СО2 – углекислый газ, а С2Н5ОН – этиловый спирт.
Спиртовому брожению может подвергаться не только глюкоза, но и другие сахаристые вещества, содержащиеся в природе в качестве растительных компонентов (например, в соке). Из чего получают спирт в этом случае? Из картофеля, свеклы, зерна пшеницы, овса, риса и т. п.
Если при получении спирта используется сырье, богатое крахмалом, то оно сначала должно поддаться осахариванию – превращению крахмала в сахар под действием определенных ферментов. При этом происходит реакция по следующей формуле:
(С6Н10О5)n + nН2О + ФЕРМЕНТ → nС6Н12О6
где (С6Н10О5)n — крахмал.
После преобразования крахмала в сахар далее получить этиловый спирт из глюкозы уже гораздо легче. Если при получении спирта используется сахаросодержащее сырье, то процесс сводится к сбраживанию подвернутого обработке сахаристого сока.
Перебродившее сырье перегоняют благодаря процессу ректификации. Для этого спиртсодержащую жидкость нагревают (доводят до кипения). При кипении спирт выпаривается и попадает в ректификационную колонну, а потом в дефлегматор. В дефлегматоре пары соприкасаются с охлажденной поверхностью, конденсируются, стекая в емкость, и образуют жидкий спирт.