Как из этилена можно получить этиловый спирт?
Содержание:
Как из этанола получить этилен уравнение реакции
Получаем этилен нагреванием смеси этилового спирта с концентрированной серной кислотой. Выделяющийся этилен пропустим через раствор брома в воде, который называют бромной водой. Бромная вода очень быстро обесцвечивается. Бром присоединяется к этилену по месту двойной связи. При этом образуется 1,2-дибромэтан.
СН2=СН2 +Br2=CH2Br—CH2Br
Реакция обесцвечивания водного раствора брома служит качественной реакцией на непредельность органических соединений.
Оборудование: колба Вюрца, капельная воронка, промывалка, газоотводная трубка, стакан или пробирка, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами, концентрированными кислотами и огнеопасными жидкостями.
Постановка опыта и текст – к.п.н. Павел Беспалов.
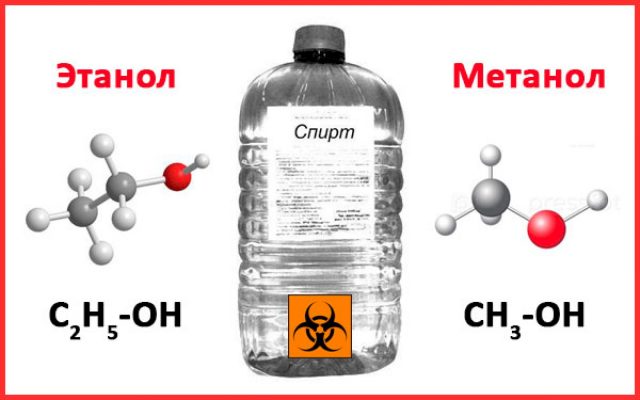
Этиловый спирт
Этиловый спирт один из самых популярных продуктов, которые используется в алкогольном производстве. Его легко спутать с другими терминами, поскольку существует также этилен.
Этилен – это бесцветный газ, который разяще отличается от привычной для нас жидкости со всем знакомым запахом. Также существует этан, который также является газообразным веществом.
Поэтому не стоит путать все эти понятия, поскольку они все разные как по формулировке, так и по свойствам.
https://www.youtube.com/watch?v=7O4kIdaXmeU
А также выдумки, которые вызывают симптомы чрезмерного употребления алкоголя, но также придают им особый вкус и аромат. Для каждого предела между полезными эффектами алкоголя и вредного воздействия разные и очень трудно определить.
Уже достаточно небольшого избытка алкоголя, чтобы вызвать «плохие симптомы»: апатия, склонность плакать или, наоборот, провоцирует агрессию.
Чрезмерный этанол в организме связан с проблемами пищеварения, ускорением потери тепла и кровяным давлением, большей восприимчивостью к различным инфекциям.
Алкоголизм Алкоголизм употребляет алкоголь; Болезнь, вызванная злоупотреблением алкогольными напитками. Читайте словарь иностранных слов подростков. Язвенная болезнь желудка. .
Этанол — это препарат, который вызывает наибольшее количество смертельных исходов, даже больше, чем все наркотические вещества, нарцитические средства растительного или синтетического происхождения.
Долгое время люди не могут различить два вида спирта:
Именно по этой причине, участились случаи отравлений и все больше людей попадают в больницу с крайней степенью тяжести.
Также стоит отметить, что подпольные цеха по производству алкоголя не придерживаются определенных технических условий и этим самым также повышают риск отравления человека, но уже этиловым спиртом.
Подробнее Биологический словарь вместе. Статистика среди молодежи еще более страшна: 64% школьников пьют алкоголь и около 21% употребляют наркотики. Так что употребление алкоголя гораздо более популярно. Этот напиток легко доступен, поэтому подростки сначала идут за банкой пива.
В обществе есть тихое разрешение выпить.
Следует подчеркнуть, что алкоголь как вещество, замедляющее центральную нервную систему, разблокирование коры головного мозга и провоцирующее государство во время феодализма было закрытой социальной группой с равным правовым статусом в государстве.
Еще одной проблемой для здоровья человека является то, что смертоносная доза метила составляет всего лишь 30-50 грамм, когда этиловый же даже в тройной дозе не принесет вреда человеческому организму.
Именно по этой причине, если вы не уверены в происхождении алкоголя, не стоит его употреблять. А самое интересное, что веществом антидотом при отравлении техническим спиртом, является именно метанол. Именно ним в медицинских учреждениях лечат тяжелые случаи отравления.
Причем его используют как для капельниц, так и для перорального употребления. Сложность возникает в том, что специалисты должны четко знать, отравление метанолом или это обычное алкогольное отравление. Цена неверного диагноза – смерть.
Получение ацетилена в промышленности и лаборатории. Химические реакции – уравнения получения ацетилена:
Ацетилен в лабораторных условиях получается в результате следующих химических реакций:
- 1. действия воды на карбид кальция:
CаС2 + H2О → Cа(ОH)2 + C2H2.
- 2. дегидрирования метана:
2CH4 → C2H2 + 3H2 (при to > 1500 оС).
- 3. дегидрирования этилена:
CH2=CH2→ СH≡CH +H2 (kat = Pt, Ni, Al2O3, Cr2O3, to = 400-600 °C).
Ацетилен в промышленности получают следующими способами и методами:
- 4. карбидным методом:
Сначала получают известь из карбоната кальция.
CаСО3 → CаО + CO2. (to = 900-1200 оС).
Затем получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при температуре 2500-3000 °С.
CаО + 3С → CаС2 + CO. (to = 2500-3000 оС).
Далее карбид кальция обрабатывают водой по известной реакции.
CаС2 + H2О → Cа(ОH)2 + C2H2.
В итоге получается ацетилен высокой чистоты – 99,9 %.
- 5. высокотемпературным крекингом метана:
Высокотемпературный крекинг метана осуществляется по известной реакции дегидирования метана в электродуговых печах при температуре 2000-3000 °С и напряжении между электродами 1000 В. Выход ацетилена составляет 50 %.
- 6. различными способами пиролиза метана:
Разновидностью высокотемпературного крекинга метана являются регенеративный пиролиз (Вульф-процесс), окислительный пиролиз (Заксе-процесс или BASF-процесс), гомогенный пиролиз, пиролиз в среде низкотемпературной плазмы.
Так, в ходе регенеративного пиролиза сначала сжигают метан и разогревают насадку печи до 1350-1400 °С. Затем через разогретую насадку на доли секунды пропускают метан, в результате образуется ацетилен.
В ходе окислительного пиролиза метан смешивают с кислородом и сжигают. Образующееся тепло служит для нагрева остатка метана до 1600 °С, который дегидрирует в ацетилен. Выход ацетилена составляет 30-32 %.
В ходе гомогенного пиролиза метан и кислород сжигают в печи при температуре 2000 °С. Затем предварительно нагретый до 600 °С остаток метана пропускают через печь, в результате образуется ацетилен.
При пиролизе в среде низкотемпературной плазмы метан нагревают струей ионизированного газа (аргона или водорода).
Технология получения
Существует всего лишь три способа, чтобы получить этиловый спирт:
- Гидролизный.
- Синтетический.
- Микробиологический.
Первый характеризуется таким процессом, как брожение. Второй, в свою очередь, включает в себя применение химических веществ, таких как ацетилен или этилен, которые вступают в химические реакции. Название третьего говорит непосредственно о самом процессе. Конечно же, каждый из них имеет свои сложные процессы, которые, в свою очередь, имеют и плюсы и минусы.
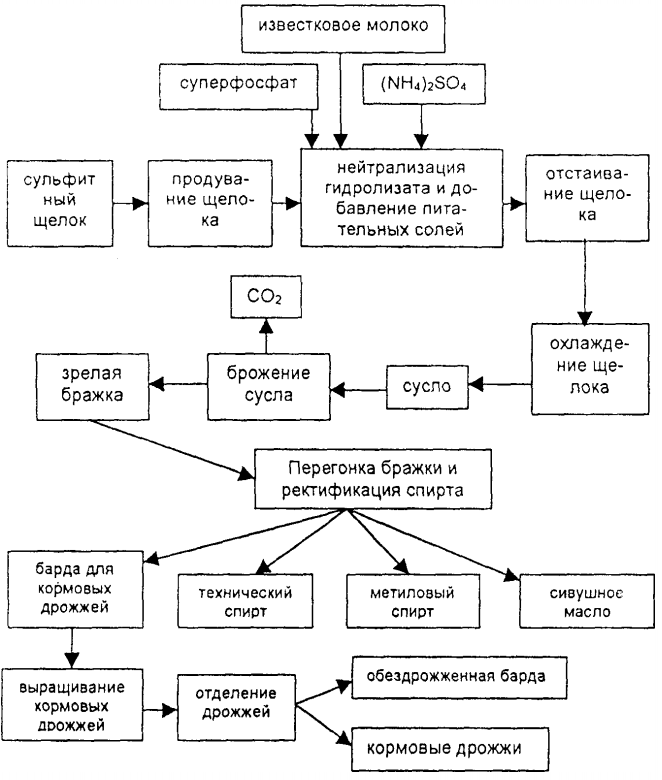
 Рассмотрим первый способ использования – для пищевых целей. Чтобы получить пищевой спирт используется первый метод – гидролизный, то есть брожение. Процесс подразумевает под собой распад виноградного сахара на две составляющих: эталон и двуокись азота. Если выделять его из других, то он является самым естественным, но самым долгим. Но, даже после брожения полученная смесь не является чистой и требуется проводить еще многие процессы для очистки и обработки готовой продукции.
Рассмотрим первый способ использования – для пищевых целей. Чтобы получить пищевой спирт используется первый метод – гидролизный, то есть брожение. Процесс подразумевает под собой распад виноградного сахара на две составляющих: эталон и двуокись азота. Если выделять его из других, то он является самым естественным, но самым долгим. Но, даже после брожения полученная смесь не является чистой и требуется проводить еще многие процессы для очистки и обработки готовой продукции.
Технический этанол получается методом химических добавок и используется два вида получения. Первым является сернокислая гидратация, но и для этого нужно выполнить несколько процессов. Но, есть более легкий способ – гидролиз. Подразумевает под собой гидратацию этилена с фосфорной кислотой. Плюс этого вида – обратимая реакция. Оба метода получения этилена не являются совершенными и требуют дальнейшей очистки и обработки. Это очень трудоемкие процессы.
Появился новый метод получения – гидролиз древесины. Довольно успешный способ, который начали часто использовать все производители. Из 10 тонн древесины удается получить 2 000 литров этанолового спирта. Довольно успешно используется данная технология в Соединенных Штатах Америки. Все больше строиться заводов, направленных на переработку и получение такого вида спирта.
Какой бы ни был спирт, он все равно вреден и не стоит забывать, что прием алкоголя любого происхождения разрушает клетки печени и приводит к смертоносным заболеваниям.
Что такое этиловый спирт или этанол
Этиловый спирт — это общее название для этанола, имеющего химическую формулу C2ЧАС5ОЙ. Здесь гидроксильная группа (-ОН) присоединена к этильной группе. Это соединение очень летучее и легковоспламеняющееся. При комнатной температуре и давлении она может существовать в виде бесцветной жидкости с характерным запахом.
Рисунок 1: Химическая структура этилового спирта
Химическая формула этилового спирта C2ЧАС6О. Молярная масса этого соединения составляет около 46 г / моль. Молекулы этилового спирта способны образовывать прочные водородные связи благодаря наличию -ОН групп. Следовательно, растворы этилового спирта имеют высокую вязкость и являются менее летучими. Этиловый спирт является хорошим растворителем для полярных соединений.
Этиловый спирт может быть получен как химическими, так и биологическими методами. Для промышленных нужд гидратация этилена является наиболее распространенным методом производства этилового спирта. Биологическим методом производства этилового спирта является брожение.
Рисунок 2: Брожение этанола
Этиловый спирт может подвергаться многим реакциям. Для производства некоторых соединений этиловый спирт является важным реагентом; например, для образования сложных эфиров, получения полимеров и т. д. в качестве реагента требуется этиловый спирт. Наиболее распространенные химические реакции этилового спирта включают дегидратацию, галогенирование, сгорание и окисление.
Есть много применений этилового спирта. Он используется в качестве основного компонента в производстве алкогольных напитков. Этиловый спирт является широко используемым растворителем для таких веществ, как краски. Кроме того, этиловый спирт является топливом. Он известен как биотопливо, полученное в процессе брожения. Этиловый спирт также полезен при производстве других химических соединений, таких как этанол и этановая кислота.
Разница между этиловым спиртом и этанолом
Этиловый спирт: Этиловый спирт — это общее название для этанола, имеющего химическую формулу C2ЧАС5ОЙ.
Этиловый спирт: Этанол — это название IUPAC для этилового спирта.
Заключение
Этиловый спирт и этанол — два термина, используемые для обозначения одного и того же химического соединения. Единственное различие между этиловым спиртом и этанолом состоит в том, что этиловый спирт является общим названием, данным для соединения C2ЧАС5OH, тогда как этанол — это название IUPAC, данное для этилового спирта. Этанол имеет ряд применений в промышленном масштабе и в лабораторном масштабе.
Рекомендации:
1. «Этанол». Национальный центр биотехнологической информации. База данных PubChem Compound, Национальная медицинская библиотека США,
Инструкция
Этиловый спирт
получают преимущественно как результат брожения сахаросодержащих продуктов, зерна, фруктов, ягод, овощей. Для этого используют ректификационные аппараты, нагревание, перегонку.
Получить этиловый спирт
из этана
простой реакцией можно в процессе каталитического окисления при нагревании до 2000 градусов в присутствии катализатора.
Другой способ получения этилового спирт
а из этана
заключается в проведении следующих реакций:1. галогенирование при температуре 1000°С и в присутствии ультрафиолетового света:С2Н6 + Cl2 = C2H5Cl2. далее проведите реакцию с щелочью:С2H5Cl +NaOH = C2H5OH + NaCl
Этиловый спирт
из этана
можно получить и еще одним способом. Проведите дегидрирование этана
при 400-5000°С в присутствии катализаторов платины Pt, никеля Ni, Al2O3:С2Н6 = С2Н4 + Н2
Этан горюч, почти нерастворим в воде, в смеси с воздухом взрывоопасен, нетоксичен. При нагревании этана
до температуры 575-10000°С он распадается на ацетилен и водород, дальнейшее нагревание приводит к обугливанию и появлению ароматических углеводородов.
В промышленности этан применяется для производства этилена — бесцветного газа, имеющего ту же химическую формулу, что и этан. В прошлом веке в сочетании с кислородом этилен применялся для наркоза. Сегодня этилен является сырьем для получения полиэтилена, винилацетата, окиси этилена, уксусной кислоты и многого другого. Этилен также является фитогормоном, влияющим на здоровье и рост многих живых организмов.
Внимание, только СЕГОДНЯ!
Все интересное
Химическая формула этилового спирта (этанола) – С2Н5ОН. А вещество хлорэтан, применяемое в качестве хладагента и для наркоза в медицинских целях, имеет формулу С2Н5Сl. Эти вещества близки по составу, только в первом случае к этильному радикалу С2Н5…
Этан и пропан – газы, простейшие представители ряда предельных углеводородов — алканов. Их химические формулы С2Н6 и С3Н8 соответственно. Этан служит сырьем для производства этилена. Пропан же используется в качестве топлива, как в чистом виде, так…
Бутан – органическое соединение алканового ряда. Это бесцветный газ, который образуется в процессе переработки (крекинге) нефти. При высоких концентрациях бутан ядовит, также этот углеводород горюч и взрывоопасен. Получают его в лаборатории и в…
Этанол, или этиловый спирт, как и этилен относятся к органическим соединениям. Этанол – это одноатомный спирт, а этилен – непредельный углеводород класса алкенов. Однако между ними существует генетическая связь, согласно которой из одного вещества…
Ацетилен относится к непредельным углеводородам. Его химические свойства определяются тройной связью. Он способен вступать в реакции окисления, замещения, присоединения и полимеризации. Этан – предельный углеводород, для которого характеры реакции…
Цепочка химических превращений — это последовательность химических реакций, в результате которых одни вещества превращаются в другие. Чтобы осуществить такую цепочку, нужно прежде всего уметь правильно записывать уравнения реакций и знать, при каких…
Этанол – бесцветное органическое вещество, обладающее резким специфическим запахом. Его используют промышленности, в лабораториях — как лучший органический растворитель, в медицине – как прекрасный антисептик. Этиловый спирт также применяют для…
Уксусный альдегид (другие названия – этаналь, ацетальдегид) имеет химическую формулу CH3COH. Внешний вид – прозрачная бесцветная жидкость, с резким «обжигающим» запахом. Кипит при комнатной температуре. Легко растворяется в воде, и…
Этан – бесцветный газ, представитель класса алканов, имеющий химическую формулу С2Н6. Этилен – также бесцветный газ, но, в отличие от этана, в природе почти не представлен. Это вещество — простейший представитель родственного алканам класса алкенов,…
Метан представляет собой простейший предельный углеводород, из которого путем последующих реакций могут быть получены другие органические вещества, в том числе и этилен. Он, как и метан, является простейшим веществом, но, в отличие от него,…
Этан — один из часто встречающихся в природе газов. Это органическое вещество, которое наравне с метаном входит в состав нефти и природного газа. Из него получают этилен, который, в свою очередь, является сырьем для получения уксусной кислоты,…
Хлорэтан (другие названия – хлористый этил, этилхлорид) представляет собою бесцветный газ, имеет химическую формулу C2Н5Cl. Смешивается с этиловым спиртом и диэтиловым эфиром, почти не смешивается с водой. Каким образом можно получить это вещество? …
Получение предельных одноатомных спиртов
К наиболее часто используемым химическим способам получения спиртов относятся:
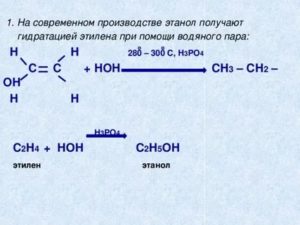
1.Гидратация алкенов (промышленный способ получения этанола для технических целей)
(t, Р, кислая среда (катализатор))
2.Щелочной гидролиз галогеналканов (лабораторный способ получения)
(водный раствор щелочи, t)
3.Восстановление альдегидов и кетонов (лабораторный способ получения)
(t, катализатор –Ni)
Особые способы получения метанола и этанола
1.Получение метанола из синтез-газа (водяной газ, генераторный газ)
(t, Р, оксидные катализаторы)
2.Получение этанола ферментативным брожением глюкозы (получение этилового спирта для пищевых и медицинских целей)
(ферменты — дрожжи)
1. Гидратация алкенов
Гидратация алкенов используется в промышленности для получения спиртов из продуктов нефтепереработки.
Присоединение воды к алкенам происходит в присутствии разбавленной серной или фосфорной кислот. Эта реакция протекает в соответствии с правилом Марковникова, поэтому первичный спирт можно получить только из этилена, а остальные алкены дают вторичные или третичные спирты:
Этот метод в лабораторных условиях нашел ограниченную область применения для получения третичных спиртов.
2. Гидролиз галогеналканов в водном растворе щелочи
В лабораторных условиях спирты получают действием водного раствора щелочи на алкилгалогениды при нагревании, при этом атом галогена в галогеналкане замещается группой –ОН:
С помощью этой реакции можно получать первичные, вторичные и третичные спирты.
При действии спиртового раствора щелочи на галогеналканы происходит отщепление галогеноводорода и образование алкена.
3. Восстановление карбонильных соединений (альдегидов и кетонов)
Дегидрирование спиртов по своей химической сущности является окислением. Обратная реакция – гидрирование альдегидов, кетонов и эфиров карбоновых кислот – является, таким образом, их восстановлением.
При действии водорода в присутствии катализаторов (Ni, Pt, Pd) альдегиды восстанавливаются до первичных спиртов, а кетоны – до вторичных спиртов:
4. Восстановление эфиров карбоновых кислот
Гидрирование сложных эфиров проходит через стадию образования альдегидов:
Этим методом в промышленности из метиловых эфиров высших кислот получают высшие первичные спирты, например:
5. Гидролиз сложных эфиров карбоновых кислот в щелочной среде
Гидролиз сложных эфиров карбоновых кислот протекает как в кислой, так и в щелочной среде (водные или спиртовые растворы NaOH, КОН, а также Ba (OH)2, Ca (OH)2, Ba (OH)2, Ca (OH)2). Однако к образованию спиртов приводит гидролиз, протекающий необратимо в щелочной среде:
6. Синтез спиртов из карбонильных соединений с помощью магнийорганических соединений
Спирты образуются при многочисленных реакциях металлоорганических соединений с различными соединениями, содержащими карбонильную группу >С=О. Этим способом можно получать как первичные спирты, так и вторичные и третичные:
7. Окисление алканов
При мягком окислении метана кислородом воздуха в присутствии различных катализаторов образуются метанол, формальдегид или муравьиная кислота:
Специфические способы получения метанола и этанола
Производство метанола крупнотоннажное, т.к. метиловый спирт является исходным веществом для получения других продуктов органического синтеза.
В промышленности
1. Получение метанола из синтез-газа (водяной газ, генераторный газ)
а) Конверсия природного газа в синтез-газ
Его получают из метана с перегретым водяным паром:
б) Каталитический синтез метанола из оксида углерода (II) и водорода
В качестве катализаторов используют смесь оксидов цинка, меди и хрома, температуру поддерживают в интервале 200-300 оС, а давление – от 40 до 150 атм.
Газ на выходе из реактора содержит 3-5% CH3OH, затем газ охлаждают и конденсируют полученный метанол, а оставшийся газ смешивают с исходным газом и направляют снова в реактор.
Ранее метанол получали сухой перегонкой древесины без доступа воздуха (отсюда его название «древесный спирт»).
2. Получение этанола спиртовым брожением глюкозы
Ферментативный гидролиз крахмала – наиболее древний синтетический процесс, используемый человеком – до сих пор имеет огромное значение для получения этилового спирта.
Протекает только в присутствии ферментов, которые вырабатывают некоторые микроорганизмы, например, дрожжи:
Глюкоза содержится во фруктовых соках. Глюкозу можно получить гидролизом крахмала (зерно, картофель, целлюлозные опилки):
Рубрики: Спирты Теги: Спирты
Свойства

Этиловый спирт, как и все другие вещества этой категории, обладает общими характеристиками. Химические и физические свойства выглядят следующим образом:
- Бесцветный газ;
- Характерный вкус и запах;
- Жидкая форма (твердая форма обретается при воздействии температуры -114);
- Плотность 0,79;
- Легко смешиваемый с другими жидкостями;
- Имеет свойство летучести (поэтому хранится в плотно закрываемых емкостях);
- Является растворителем;
- Имеет антисептический эффект;
- Опасен для организма в любом виде (как в жидком, так и в газообразном);
- Психоактивное и наркотическое вещество;
- Входит в разряд ядов;
Ввиду всех вышеперечисленных свойств он очень токсичен. Для взрослого человека смертельная доза всего лишь 450 миллилитров при условии 96 % чистого раствора, для детей она равняется 35. Несмотря на все это, этиловый спирт широко распространен во многих производствах, что делает его свойства универсальными.
Не каждый понимает, что бокал вина, олово может быть порожден в бриофитах. Встречается в верхней части спорофита, обычно покрывается крышкой и покрывается колпачком. Внутри коробки есть архпольная ткань. Подробнее Биологический словарь пива или стакана водки содержит такое же количество алкоголя. Этот препарат разрушает не только клетки быстро развивающегося организма: мозг, печень и сердце, но также оказывает значительное влияние на интеллектуальное развитие.
Это вызывает многочисленные врожденные дефекты, приводящие к раку, таким как рак молочной железы. Его токсический эффект больше, даже от таких препаратов, как героин. Время, требуемое подростку, чтобы стать зависимым, составляет в среднем от шести месяцев до трех лет, а взрослым, с другой стороны, требуется от пяти до десяти лет. Привычка детей намного сложнее и требует много времени. У подростка, не имеющего жизненного опыта, нет оснований, чтобы выбраться из его привычки.
Часто можно увидеть такую надпись, как «Этиловый спирт ректификованный», это значит, что жидкость прошла очистку от вредных примесей. Но, полностью извлечь из него их невозможно, но такая процедура минимизирует их присутствие. Также встречается денатурированный вид. Такой вид характеризуется примесями, которые полностью исключают возможность приема перорально, но не отрицают его основное использование – денатурат.
В настоящее время зависимость очень проста. Всеохватывающая реклама, так называемая. «плохая компания», входящая в подростковый возраст, являются лишь некоторыми причинами использования «бутылок» или наркотиков. Алкоголь также может оказывать положительное воздействие на организм, если его потребляют в разумных количествах. Он улучшает кровообращение, нагревает или помогает расслабиться. Например, стакан красного вина повышает уровень хорошего холестерина в крови, защищая от атеросклероза. Микроорганизмы микроорганизмы — одноклеточные организмы различной систематической принадлежности — бактерии, цианобактерии, простейшие и некоторые водоросли и грибы.
 В зависимости от использования его различают:
В зависимости от использования его различают:
- Пищевого применения.
- Технического применения.
- Медицинского применения.
Для каждого из них существуют свои стандарты и технологии производства. Также на упаковке указывается процентное содержание этила в жидкости.
Распространение в природе
Этанол является продуктом жизнедеятельности некоторых грибов. Среди них основными являются рода Saccharomyces, Schizosaccharomyces, а также Kluyveromyces. Одним из наиболее известных представителей этих классов является вид Saccharomyces cerevisiae, который имеет тривиальное название пивные дрожжи. К другим распространенным видам относятся Saccharomyces pastorianus, Saccharomyces anamensis, Schizosaccharomyces pombe, Candida utilis тому подобное. Также этанол образуют некоторые бактерии, например, Zymomonas mobilis.
В 1975 году астрономы сообщили о нахождении значительных скоплений этанола в газо-пылевом облаке Стрелец B2. По подсчетам ученых количество имеющихся там молекул этанола значительно превышает количество спирта, полученного за всю историю человечества. Найденный этанол имел транс-форму молекул, а в 1996 году он был зафиксирован и в гош -форме.
Среди возможных путей образования этанола в межзвездной среде приводится, в частности, его синтез из метана и метил-катиона под действием излучения:
Другим потенциальным способом является взаимодействие метил-катиона с формальдегидом, который также распространен в космосе:
Свойства

Этиловый спирт, как и все другие вещества этой категории, обладает общими характеристиками. Химические и физические свойства выглядят следующим образом:
- Бесцветный газ;
- Характерный вкус и запах;
- Жидкая форма (твердая форма обретается при воздействии температуры -114);
- Плотность 0,79;
- Легко смешиваемый с другими жидкостями;
- Имеет свойство летучести (поэтому хранится в плотно закрываемых емкостях);
- Является растворителем;
- Имеет антисептический эффект;
- Опасен для организма в любом виде (как в жидком, так и в газообразном);
- Психоактивное и наркотическое вещество;
- Входит в разряд ядов;
Ввиду всех вышеперечисленных свойств он очень токсичен. Для взрослого человека смертельная доза всего лишь 450 миллилитров при условии 96 % чистого раствора, для детей она равняется 35. Несмотря на все это, этиловый спирт широко распространен во многих производствах, что делает его свойства универсальными.
Часто можно увидеть такую надпись, как «Этиловый спирт ректификованный», это значит, что жидкость прошла очистку от вредных примесей. Но, полностью извлечь из него их невозможно, но такая процедура минимизирует их присутствие. Также встречается денатурированный вид. Такой вид характеризуется примесями, которые полностью исключают возможность приема перорально, но не отрицают его основное использование – денатурат.
 В зависимости от использования его различают:
В зависимости от использования его различают:
- Пищевого применения.
- Технического применения.
- Медицинского применения.
Для каждого из них существуют свои стандарты и технологии производства. Также на упаковке указывается процентное содержание этила в жидкости.
Взрывоопасность ацетилена и безопасность при обращении с ним:
Ацетилен обладает взрывоопасными свойствами.
Поэтому обращение с ацетиленом требует строгого соблюдения правил техники безопасности.
Ацетилен горит и взрывается даже в отсутствии кислорода и других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций.
Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Взрываемость ацетилена зависит от множества факторов: давления, температуры, чистоты ацетилена, содержания в нем влаги, наличия катализаторов и пр. веществ и ряда других причин.
Температура самовоспламенения ацетилена при нормальном – атмосферном давлении колеблется в пределах 500-600 °C. При повышении давления существенно уменьшается температура самовоспламенения ацетилена. Так, при давлении 2 кгс/см2 (0,2 МПа, 1,935682 атм.) температура самовоспламенения ацетилена равна 630 °C. А при давлении 22 кгс/см2 (2,2 МПа, 21,292502 атм.) температура самовоспламенения ацетилена равна 350 °С.
Присутствие в ацетилене частиц различных веществ увеличивают поверхность его контакта и тем самым снижает температуру самовоспламенения при атмосферном давлении. Например, активированный уголь снижает температуру самовоспламенения ацетилена до 400 °С, гидрат оксида железа (ржавчина) – до 280-300 °С, железная стружка – до 520 °С, латунная стружка – до 500-520 °С, карбид кальция – до 500 °С, оксид алюминия – до 490 °С, медная стружка – 460 °С, оксид железа – 280 °С, оксид меди – до 250 °С.
Взрывоопасность ацетилена уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При определенных условиях ацетилен реагирует с медью, серебром и ртутью образуя взрывоопасные соединения. Поэтому при изготовлении ацетиленового оборудования (например, вентилей баллонов) запрещается применять сплавы, содержащие более 70 % Cu.
Для хранения и перевозки ацетилена используются специальные стальные баллоны белого цвета (с красной надписью «А»), заполненные инертным пористым материалом (например, древесным углём). При этом ацетилен хранится и перевозится в указанных баллонах в виде раствора ацетилена в ацетоне под давлением 1,5-2,5 МПа.
Примечание: Фото //www.pexels.com, //pixabay.com
Как возможно научиться писать тексты и зарабатывать на этом удаленно? Например, можете пройти курс «Копирайтинг от А до Я», который подойдет даже начинающим авторам.
Другие записи:
карта сайта
как получить ацетилен реакция ацетилен этен 1 2 вещество кислород водород связь является углекислый газ бромная водауравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение ацетиленанапишите уравнение реакций ацетилен
Коэффициент востребованности
8 913