Алканы. тематические тесты для подготовки к егэ
Содержание:
Окислительное дегидрирование этана
Реакция окислительного дегидрирования этана (ОДЭ) производится по следующей формуле:
C2H6 + 1/2O2 = C2H4 + H2O (1)
В качестве окислителя может применяться как концентрированный кислород, так и кислород в составе воздуха. Последние опыты по окислительному дегидрированию этана показали следующие результаты (в качестве окислителя применялся кислород с концентрацией 99,5 %):
- конверсия этана 74,0 %;
- селективность по этилену 82,0 %.
С использованием полученных данных была разработана схема выделения этилена из контактного газа окислительного дегидрирования этана, основанная на абсорбционном методе извлечении этан-этиленовой фракции. Принципиальная схема получения этилена путем ОДЭ представлена на рис. 2.
 Рис. 2. Технология получения этилена методом ОДЭ
Рис. 2. Технология получения этилена методом ОДЭ
Схема включает реакционный узел Р-1, узел водной отмывки К-1, стадию предварительного удаления СО2 путем аминовой хемосорбции К-2, компримирования М-1, осушку С-1, колонны абсорбции и десорбции ЭЭФ (соответственно К-3 и К-4), колонну выделения товарного этилена К-5.
Разработанная технология является достаточно гибкой, чтобы проводить окислительное дегидрирование как концентрированным кислородом, так и кислородом воздуха или какой-либо промежуточной смесью воздухкислород. Для любого случая в зависимости от применяемого окислителя в представленной технологии решена проблема образования взрывоопасных смесей кислород-углеводороды-монооксид углерода, что делает технологию простой и безопасной.
Кроме того, гибкость технологии позволяет использовать различные катализаторы окислительного дегидрирования этана, т.е. при появлении новых катализаторов, являющихся по тем или иным характеристикам лучше ныне существующих, их также можно применять в данной технологической схеме.
Благодаря разработанной технологии, а также применению абсорбционной технологии выделения ЭЭФ из контактного газа, исключающей использование хладагентов с температурой ниже минус 37 °С, удалось достичь приемлемых для промышленной установки показателей эксплуатационных параметров. При моделировании технологии были получены следующие результаты:
Расходный коэффициент по сырью, т этана/т этилена 1,29
Расход электроэнергии, МВт⋅ч/т этилена 0,60
Степень извлечения этилена, % 98,5
Моделирование технологии ОДЭ с применением концентрированного кислорода показало значительно более низкие эксплуатационные затраты по сравнению с пиролизом этана (в качестве примера: потребление электроэнергии составляет соответственно 0,6 и 1,0).
Кроме того, технология ОДЭ имеет значительно более простую схему выделения этилена: отсутствуют узлы каталитического удаления ацетилена, низкотемпературного (до минус 100 °С) удаления метана и водорода и другие. В связи с этим данный способ получения этилена претендует на получение высоких результатов при дальнейших более подробных оценках экономической целесообразности реализации данного проекта.
3. Лабораторные методы получения этанола
https://www.youtube.com/watch?v=UmS378Md-Qc
Существует также еще достаточно много лабораторных методов получения этанола.
Этанол образуется при гидролизе галогенозамищеного этана . Поскольку реакция может проходить в обоих направлениях, ее проводят в присутствии щелочей или карбонатов для смещения равновесия вправо.
Реакция проводится аналогично промышленном метода получения синтетического этанола.
https://youtube.com/watch?v=6FkdU5fFMoU
Восстановление карбонильной группы в гидроксильной является довольно распространенным лабораторным методом получения
Два способа, как получить этилен
- из этана термически, в присутствии Аl2О3. Но таким способом получают этилен в промышленности.
- из этана под действием серной кислоты (H2SO4), так называемого дегидратирующего агента (вещества, связывающего воду).
Мы рассмотрим второй способ.
Как получить этилен из этана
Получение происходит в результате простой химической реакции:
Этот способ доступен и в бытовых условиях. Вам нужно поместить какое-то количество спирта в емкость, добавить аккуратно H2SO4. Так как этилен немного легче воздуха, то его нужно собирать в открытый, перевернутый вверх дном сосуд, закрепив тот вертикально. В него будет скапливаться газ в результате реакции.
Во время проведения реакции следует быть крайне осторожным, так как кислота может обжечь глаза или попасть на кожу.
Когда реакция закончится, не переворачивая верхнюю емкость, закрываете ее. Все. Газ вы получили.
гидрирование алкенов в присутствии катализаторов:
C2H6=C2H4+H2 путем пиролиза
Применение метана
Метан используется в качестве топлива для печей, водонагревателей, автомобилей, турбин и др. Для хранения метана может использоваться активированный уголь.
Как основной компонент природного газа, метан важен для производства электроэнергии, сжигая его в качестве топлива в газовой турбине или парогенераторе. По сравнению с другими видами углеводородного топлива метан производит меньше углекислого газа на каждую единицу выделенного тепла. При температуре около 891 кДж/моль теплота сгорания метана ниже, чем у любого другого углеводорода. Тем не менее, он производит больше тепла на массу (55,7 кДж/г), чем любая другая органическая молекула из-за его относительно большого содержания водорода, что составляет 55 % теплоты сгорания, но отдаёт только 25 % молекулярной массы метана. Во многих городах метан подаётся в дома для отопления и приготовления пищи. В этом контексте его обычно называют природным газом, содержание энергии в котором составляет 39 мегаджоулей на кубический метр. Сжиженный природный газ (СПГ) представляет собой преимущественно метан (CH4), превращаемый в жидкую форму для удобства хранения или транспортировки.
Рафинированный жидкий метан, в сочетании с жидким кислородом, рассматривается в качестве перспективного ракетного топлива и используется в таких двигателях, как BE-4 и Raptor. Метан имеет преимущества перед керосином в том, что он:
- даёт бо́льший удельный импульс;
- оставляет меньше продуктов сгорания на внутренних частях ракетных двигателей;
- позволяет легче освободить полости двигателя от остатков топлива.
Это уменьшает сложность повторного использования ракет.
Метан используется в качестве сырья в органическом синтезе, в том числе для изготовления метанола.
Дегидратация биоэтанола
Реакция дегидратации этанола производится по следующей формуле:
C2H5OH = C2H4 + H20 (2)
Последние опыты по окислительному дегидрированию этилена показали следующие результаты:
- выход этилена, близкий к теоретическому, потребление сырья 1,77…1,87 т этанола/т этилена;
- содержание этилена в контактном газе после конденсации основной части реакционной воды 96–97% мас.;
- состав контактного газа позволяет исключить из технологии выделения этилена из реакционных газов дегидратации биоэтанола стадию удаления «легких» компонентов – содержание в смеси реакционных газов метана, СО и водорода не превышает 0,04% мас., что дает возможность получить этилен полимеризационной чистоты без применения упомянутой стадии газоразделения.
Таким образом, была разработана технология выделения этилена из реакционных газов, принципиальная схема технологии представлена на рис. 3.
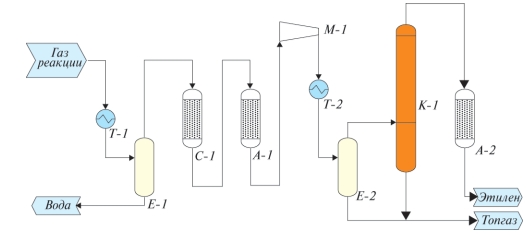 Рис. 3. Принципиальная схема технологии выделения этилена из реакционных газов дегидратации биоэтанола
Рис. 3. Принципиальная схема технологии выделения этилена из реакционных газов дегидратации биоэтанола
Схема включает узел конденсации реакционной воды Т-1, предварительную осушку С-1, узел удаления кислородсодержащих примесей А-1, компримирования М-1, колонну выделения товарного этилена К-1 и стадию доочистки этилена от остаточных примесей А-2.
Благодаря высокой селективности процесса, а также отсутствию стадии удаления «легких» компонентов, технология выделения этилена из реакционных газов дегидратации биоэтанола при моделировании показала весьма привлекательные коэффициенты эксплуатационных параметров. Например, потребление электроэнергии составило 0,35 МВт/т. этилена.
Учитывая простоту разделения газов дегидратации биоэтанола, низкий расходный коэффициент по сырью, а также низкие эксплуатационное параметры, можно сделать следующие выводы:
- процесс получения этилена из биоэтанола может быть конкурентоспособным способам получения этилена из нефтяного сырья;
- процесс имеет хорошие перспективы для реализации в странах, где нет прямого доступа к нефтяному сырью и имеется доступное сырье для производства биоэтанола (Украина, страны Южной Азии, страны Южной Америки и др.);
- процесс может быть альтернативой аналогичным, но более энергозатратным технологиям получения этилена из этанола, в странах, где рентабельность получения биоэтилена уже доказана, и подобные процессы реализуются в промышленном масштабе (Бразилия).
В РФ имеется большой потенциал для производства биоэтанола как для нужд нефтехимии, так и для использования в качестве присадок к жидкому топливу, однако из-за акцизной политики государства биоэтанол не может быть реализован как продукт, так как это повлечет за собой высокую себестоимость биоэтанола ввиду попадания под акциз (доля акциза достигает значений до 90 %).
Данный фактор затрудняет возможность использования биоэтанола в качестве сырья для получения этилена, так как требует реализацию такого процесса в рамках предприятия, также производящего биоэтанол, что влечет за собой дополнительные трудности, связанные с различной спецификой аграрных и нефтехимических производств.
Особенности этана
Данный парафин является вторым в гомологическом ряду алканов. Он имеет в сравнении с ним более высокую температуру кипения. Оба этих насыщенных углеводорода являются гомологами. Они имеют сходное химическое строение, подобные свойства. Единственным отличием между ними является группа СН2, которая называется гомологической разницей.
Рассмотрим еще один вариант того, как получить этан из метана. Например, можно осуществить частичное окисление метана до ацетилена. Полученный алкин, имеющий тройную связь в молекуле, подвергается каталитическому гидрированию. Продуктом взаимодействия будет именно этан. Осуществляется гидрирование по радикальному механизму. Несмотря на многообразие вариантов, для того чтобы определиться, как получить этан из метана, необходимо проанализировать условия протекания каждого отдельного процесса.
В настоящее время ответом на вопрос о том, как получить этан из метана, являетя частичное окисление с последующим гидрированием.

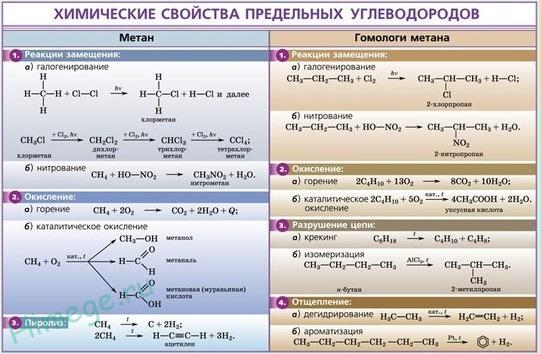
Химические свойства этилена (этена):
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства этилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое гидрирование (восстановление) этилена:
CH2=CH2 + H2 → CH3-CH3 (kat = Ni, Pd, Pt, to).
- 2. галогенирование этилена:
CH2=CH2 + Br2 → CH2Br -CH2Br.
Однако при нагревании этилена до температуры 300 oC разрыва двойной углерод-углеродной связи не происходит – реакция галогенирования протекает по механизму радикального замещения:
CH2=CH2 + Br2→ CH2=CH-Br + HBr (t = 300 oC).
- 3. гидрогалогенирование этилена:
CH2=CH2 + HBr → CH3-CH2Br.
- 4. гидратация этилена:
CH2=CH2 + H2O → CH3-CH2ОН (H+, to).
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется этанол.
- 5. окисление этилена:
Этилен легко окисляется. В зависимости от условий проведения реакции окисления этилена могут быть получены различные вещества: многоатомные спирты, эпоксиды или альдегиды.
Например,
2CH2=CH2 + O2 → 2C2OH4 (kat = Ag, to).
В результате образуется эпоксид.
2CH2=CH2 + O2 → 2CH3-C(O)H (kat = PdCl2, CuCl, t = 200oС ).
В результате образуется ацетальдегид.
- 6. горение этилена:
CH2=CH2 + 3O2 → 2CO2 + 2H2O.
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и вода.
- 7. полимеризация этилена:
nCH2=CH2 → (-CH2-CH2-)n (kat, to).
3. Лабораторные методы получения этанола
Существует также еще достаточно много лабораторных методов получения этанола.
3.1. Гидролиз галогенпроизводных углеводородов
Этанол образуется при гидролизе галогенозамищеного этана . Поскольку реакция может проходить в обоих направлениях, ее проводят в присутствии щелочей или карбонатов для смещения равновесия вправо.
3.3. Восстановление карбонильных соединений
Восстановление карбонильной группы в гидроксильной является довольно распространенным лабораторным методом получения
Химические свойства спирта
химические свойства1.Взаимодействие спиртов со щелочными металлами (образование алкоголятов)
Дегидратация спиртов
Список литературы
Инструкция
Этиловый спирт
получают преимущественно как результат брожения сахаросодержащих продуктов, зерна, фруктов, ягод, овощей . Для этого используют ректификационные аппараты, нагревание, перегонку.
Другой способ получения этилового спирт
а из этана
заключается в проведении следующих реакций:1. галогенирование при температуре 1000°С и в присутствии ультрафиолетового света:С2Н6 + Cl2 = C2H5Cl2. далее проведите реакцию с щелочью:С2H5Cl +NaOH = C2H5OH + NaCl
Этиловый спирт
из этана
можно получить и еще одним способом. Проведите дегидрирование этана
при 400-5000°С в присутствии катализаторов платины Pt, никеля Ni, Al2O3:С2Н6 = С2Н4 + Н2
Видео по теме
Обратите внимание
Приготовление чистого этилового спирта в домашних условиях практически невозможно, он всегда будет содержать примеси ядовитого метилового спирта.
Хлорэтан
(другие названия – хлористый этил, этилхлорид) представляет собою бесцветный газ, имеет химическую формулу C2Н5Cl. Смешивается с этиловым спиртом и диэтиловым эфиром, почти не смешивается с водой. Каким образом можно получить это вещество?
Инструкция
Второй способ – гидратация этилена. Гидратацию проводят под давлением, при температуре 300°С:CH?=CH? + H?O = C?H?OH.
Третий способ – получение этанола из этана в щелочной среде с последующей очисткой. На первой стадии образуется бромэтан , на второй — этиловый спирт
:CH?-CH? + HBr = CH?-CH?Br + HBr;CH?-CH?Br + H?O =NaOH= C?H?OH +HBr.
Видео по теме
как получить этиловый спирт в 2017
Ацетилен относится к непредельным углеводород ам. Его химические свойства определяются тройной связью. Он способен вступать в реакции окисления, замещения, присоединения и полимеризации. Этан
– предельный углеводород, для которого характеры реакции замещения по радикальному типу, дегидрирования и окисления. При температуре около 600 градусов по Цельсию он разлагается на водород и этен.
Вам понадобится
- — химическое оборудование;
- — катализаторы;
- — бромная вода.
Инструкция
Ацетилен, этилен и этан — в обычных условиях бесцветные горючие газы. Поэтому сначала ознакомьтесь с техникой безопасности при работе с летучими веществами. Не забудь повторить строение молекул и химические свойства алкинов (непредельных углеводородов), алкенов и алканов. Посмотрите, чем они похожи и чем различаются. Для получения этана вам потребуется ацетилен и водород .
Чтобы произвести ацетилен в лабораторных условиях, проведите разложение карбида кальция CaC2. Его можете взять готовым или же получить путем спекания негашеной извести с коксом: СаО+3C=CaC2+CO — процесс протекает при температуре 2500°C, СаС2+2Н2O=C2H2+Са(ОН)2.Проведите качественную реакцию на ацетилен — обесцвечивание бромной воды или раствора перманганата калия.
Получить водород вы сможете несколькими способами: — взаимодействием металлов с кислотой: Zn+2 НСl=ZnСl2+Н2- во время реакция щелочи с металлами,