Этилен
Содержание:
Источники
|
|
|
Ацетилен и его гомологи
Ацетилен – это непредельный углеводород, который содержит тройную связь, состоящую из одной δ-связи и двух π-связей.
1) первый представитель ряда ацетилена – бесцветный газ.
Особенности бесцветного газа:
а) немного растворим в воде;
б) его молекулярная формула С2Н2;
2) в молекуле ацетилена еще на два атома водорода меньше, чем в молекуле этилена;
3) π-связь уступает по прочности основной δ-связи, поэтому и по месту π-связей могут проходить реакции окисления и присоединения.
Структурная формула ацетилена: НС≡СН.
1) тройная связь в молекуле ацетилена означает, что атомы углерода в ней соединены тремя парами электронов;
2) исследования строения молекулы ацетилена показывают, что атомы углерода и водорода в молекуле ацетилена расположены на одной прямой;
3) молекула ацетилена имеет линейное строение;
4) атомы углерода соединены между собой одной δ-связью и двумя π-связями.
Особенности строения молекулы ацетилена:
1) в такой молекуле каждый атом углерода соединен δ-связями только с двумя другими атомами (атом углерода и атом водорода) и в гибридизации здесь участвуют лишь два электронных облака – одного s-электрона и одного р-электрона.
Это случай sр-гибридизации.
Суть состоит в том, что два гибридных облака, которые образуются в виде несимметричных объемных восьмерок, стремятся максимально удалиться друг от друга и устанавливают связи с другими атомами во взаимно противоположных направлениях под углом 180°;
2) облака двух других р-электронов не участвуют в гибридизации.
Они сохраняют форму симметричных объемных восьмерок и при боковом перекрывании с подобными облаками другого углеродного атома образуют две π-связи.
1) подобно метану и этилену, ацетилен начинает собой гомологический ряд;
2) это ряд ацетиленовых углеводородов с одной тройной связью между атомами углерода в молекуле;
3) согласно систематической номенклатуре название таких углеводородов образуются путем замены суффикса – ан соответствующих предельных углеводородов на – ин;
4) как и этиленовые углеводороды, атомы углерода нумеруются начиная с того конца, к которому ближе кратная (тройная) связь:
Особенности изомерии: а) обусловлена разветвлением углеродного скелета; б) характерное положение тройной связи; в) помогает в получении и использовании ацетилена в различных сферах.
Этилен (этен), формула, газ, характеристики:
Этилен (этен) – органическое вещество класса алкенов, состоящий из двух атомов углерода и четырех атомов водорода. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Химическая формула этилена C2H4, рациональная формула H2CCH2, структурная формула CH2=CH2. Изомеров не имеет.
Строение молекулы:
Этилен – бесцветный газ, без вкуса, со слабым запахом. Легче воздуха.
Этилен является фитогормоном, т.е. низкомолекулярным органическим веществом, вырабатываемым растениями и имеющим регуляторные функции. Он образуется в тканях самого растения и выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов), распускание бутонов (процесс цветения), старение и опадание листьев и цветков, участие в реакции растений на биотический и абиотический стресс, коммуникации между разными органами растений и между растениями в популяции.
Пожаро- и взрывоопасен.
Плохо растворяется в воде. Зато хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Этилен — самое производимое органическое соединение в мире.
Химические и физические свойства
Некоторые химические свойства
Свойства ацетилена во многом определены его формулой. То есть наличием атомов углерода и водорода связанных между собой.
Смешивание ацетилена с водой, при добавлении катализаторов типа солей ртути, приводит к получению уксусного альдегида. Тройная связь атомов, содержащихся в молекуле ацетилена приводит к тому, что при сгорании она выделяет 14 000 ккал/куб. м. В процессе сгорания температура поднимается до 3000 °C.
Этот газ, при соблюдении определенных условий, может превращаться в бензол. Для этого необходимо разогреть его до 4000 °С и добавить графит.
Водород, содержащийся в молекулах показывает кислотные свойства. То есть они довольно легко отрываются от молекулы в виде протонов. Ацетилен в состоянии обесцвечивает воду содержащую бром и раствор «марганцовки».
Молярная масса ацетилена составляет 26,04 г/моль. Плотность ацетилена 1,1 кг/м³.
Физические свойства
В стандартных условиях ацетилен представляет собой бесцветный газ, который практически не растворяется в воде. Он начинает кипеть в -830 °С. При сжимании он начинает разлагаться с выделением большого количества энергии. Поэтому для его хранения применяют стальные баллоны способные хранить газ под высоким давлением.
Этот газ недопустимо выпускать в атмосферу. Его формула может отрицательно сказываться на окружающей среде.
Примеры решения задач
| Задание | Эквимолекулярная смесь ацетилена и формальдегида полностью реагирует с 69,6 г Ag2O, растворенного в аммиаке. Определите состав исходной смеси. |
| Решение | Запишем уравнения реакций, указанных в условии задачи: |
Рассчитаем количество вещества оксида серебра (I):
n(Ag2O) = 69,6 / 232 = 0,3 моль.
По уравнению (2) количество вещества формальдегида будет равно 0,1 моль. По условию задачи смесь эквимолекулярна, следовательно, ацетилена тоже будет 0,1 моль.
Найдем массы веществ, составляющих смесь:
M(HC≡CH) = 26 г/моль;
M(H-C(O)H) = 30 г/моль;
m(HC≡CH) = 0,1 × 26 = 2,6 г;
m(H-C(O)H) = 0,1 × 30 = 3 г.
Ответ Масса ацетилена равна 2,6 г, формальдегида – 3 г.
| Задание | При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси. |
| Решение | При пропускании смеси пропана и ацетилена через склянку с бромной водой происходит поглощение ацетилена. Запишем уравнение химической реакции, соответствующее этому процессу: |
Таким образом, значение, на которое увеличилась масса склянки (1,3 г) представляет собой массу ацетилена. Найдем количество вещества ацетилена (молярная масса – 26 г/моль):
Запишем уравнение реакции сгоранияацетилена:
Согласно уравнению реакции, в неё вступило 2 моль ацетилена, однако, известно, что 0,05 моль из этого количества поглотилось бромной водой. Т.е. выделилось:
Найдем общее количество оксида углерода (IV):
Запишем уравнение реакции сгорания пропана:
Учитывая, что в реакции сгорания ацетилена выделилось 0,1 моль оксида углерода (IV), количество вещества оксида углерода (IV), выделившееся в ходе сгорания пропана равно:
0,625 — 0,1 = 0,525 моль СО2.
Найдем количество вещества пропана, вступившего в реакцию горения. Согласно уравнению реакции n(CO2) : n(С3Н8) = 3 : 1, т.е.
Вычислим массу пропана (молярная масса 44 г/моль):
Тогда, общая масса смеси углеводородов составит:
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
Галогенирование
(электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
CH 2 = CH 2 + Br 2 = Br-CH 2 -CH 2 Br.
Галогенирование этилена возможно также при нагревании (300С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
CH 2 = CH 2 + Cl 2 → CH 2 = CH-Cl + HCl.
Гидрогалогенирование
— взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
CH 2 = CH 2 + HCl → CH 3 -CH 2 -Cl.
Гидратация
— взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
CH 2 = CH 2 + H 2 О → CH 3 -CH 2 -ОН.
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты
(1), реакции гидрокси-
и алкоксимеркурирования
(2, 3) (получение ртутьорганических соединений) и гидроборирование
(4):
CH 2 = CH 2 + HClO → CH 2 (OH)-CH 2 -Cl (1);
CH 2 = CH 2 + (CH 3 COO) 2 Hg + H 2 O → CH 2 (OH)-CH 2 -Hg-OCOCH 3 + CH 3 COOH (2);
CH 2 = CH 2 + (CH 3 COO) 2 Hg + R-OH → R-CH 2 (OCH 3)-CH 2 -Hg-OCOCH 3 + CH 3 COOH (3);
CH 2 = CH 2 + BH 3 → CH 3 -CH 2 -BH 2 (4).
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
2 ON-CH = CH 2 + HCN → 2 ON-CH 2 -CH 2 -CN.
В ходе реакций окисления
этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления. Так, при окислении этилена в мягких условиях
(окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля:
3CH 2 = CH 2 + 2KMnO 4 +4H 2 O = 3CH 2 (OH)-CH 2 (OH) +2MnO 2 + 2KOH.
При жестком окислении
этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
Окисление
этилена кислородом
при 200С в присутствии CuCl 2 и PdCl 2 приводит к образованию ацетальдегида:
CH 2 = CH 2 +1/2O 2 = CH 3 -CH = O.
При восстановлении
этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH 2 = CH 2 + H 2 = CH 3 -CH 3 .
Этилен вступает в реакцию полимеризации
. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот
(катионный механизм) или радикалов (радикальный механизм):
n CH 2 = CH 2 = -(-CH 2 -CH 2 -) n -.
Примечания
- Devanney Michael T. (англ.) (недоступная ссылка). SRI Consulting (September 2009).
- (англ.) (недоступная ссылка). WP Report. SRI Consulting (January 2010).
- (недоступная ссылка). Дата обращения 21 января 2007.
- Хомченко Г.П. §16.6. Этилен и его гомологи // Химия для поступающих в вузы. — 2-е изд. — М.: Высшая школа, 1993. — С. 345. — 447 с. — ISBN 5-06-002965-4.
- В. Ш. Фельдблюм. Димеризация и диспропорционирование олефинов. М.: Химия, 1978
- ↑
- ↑ Лутова Л.А. Генетика развития растений / ред. С.Г. Инге-Вечтомов. — 2-е изд.. — Санкт-Петербург: Н-Л, 2010. — С. 432.
- Нелюбов Д. Н. О горизонтальной нутации у Pisum sativum и некоторых других растений (рус.) // Труды Санкт-Петербургского Общества Естествознания : журнал. — 1901. — Т. 31, № 1., также Beihefte zum «Bot. Centralblatt», т. Х, 1901
- Crocker W, Hitchcock AE, Zimmerman PW. (1935) «Similarities in the effects of ethlyene and the plant auxins». Contrib. Boyce Thompson Inst. 7. 231-48. Auxins Cytokinins IAA Growth substances, Ethylene
Физиологическое действие
Метан является самым физиологически безвредным газом в гомологическом ряду парафиновых углеводородов. Физиологическое действие метан не оказывает и не ядовит (из-за малой растворимости метана в воде и плазме крови и присущей парафинам химической инертности). Погибнуть человеку в воздухе с высокой концентрацией метана можно только от недостатка кислорода в воздухе. Так, при содержании в воздухе 25—30 % метана появляются первые признаки удушья (учащение пульса, увеличение объёма дыхания, нарушение координации тонких мышечных движений и т. д.). Более высокие концентрации метана в воздухе вызывают у человека кислородное голодание — головную боль, одышку, — симптомы, характерные для горной болезни.
Так как метан легче воздуха, он не скапливается в проветриваемых подземных сооружениях. Поэтому случаи гибели людей от удушья при вдыхания смеси метана с воздухом весьма редки.
Первая помощь при тяжёлом удушье: удаление пострадавшего из вредной атмосферы. При отсутствии дыхания немедленно (до прихода врача) искусственное дыхание изо рта в рот. При отсутствии пульса — непрямой массаж сердца.
Хроническое действие метана
У людей, работающих в шахтах или на производствах, где в воздухе присутствуют в незначительных количествах метан и другие газообразные парафиновые углеводороды, описаны заметные сдвиги со стороны вегетативной нервной системы (положительный глазосердечный рефлекс, резко выраженная атропиновая проба, гипотония) из-за очень слабого наркотического действия этих веществ, сходного с наркотическим действием диэтилового эфира.
ПДК метана в воздухе рабочей зоны составляет 7000 мг/м³.
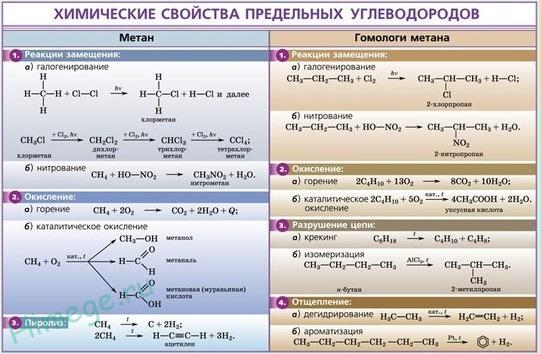
Химические свойства алкинов.
Химические свойства алкинов объясняет наличие тройной связи в молекуле алкина. Типичная реакция для алкинов – реакция присоединения, которая протекает в 2 стадии. На первой происходит присоединение и образование двойной связи, а на второй – присоединение к двойной связи. Реакция у алкинов протекает медленнее, чем и алкенов, т.к. электронная плотность тройной связи «размазана» более компактно, чем у алкенов, и поэтому менее доступна для реагентов.
1. Галогенирование. Галогены присоединяются к алкинам в 2 стадии. Например,
А суммарно:
Алкины также как алкены обесцвечивают бромную воду, поэтому эта реакция является качественной и для алкинов.
2. Гидрогалогенирование. Галогенводороды присоединяются к тройной связи несколько тружднее, чем к двойной. Для ускорения (активации) процесса используют сильную кислоту Льюиса – AlCl3. Из ацетилена при таких условиях модно получить винилхлорид, который идет на производства полимера – поливинилхлорида, имеющего важнейшее значение в промышлености:
.
Если же галогенводород в избытке, то реакция (особенно у несимметричных алкинов) идет по правилу Марковникова:
3. Гидратация (присоединение воды). Реакция протекает только в присутствии солей ртути (II) в качестве катализатора:
На 1ой стадии образуется непредельный спирт, в котором гидроксигруппа находится у атома углерода, образующего двойную связь. Такие спирты называются виниловыми или фенолами.
Отличительная черта таких спиртов – неустойчивость. Они изомеризуются в более стабильные карбонильные соединения (альдегиды и кетоны) вследствие переноса протона от ОН-группы к углероду при двойной связи. При этом π-связь рвется (между атомами углерода), и образуется новая π-связь между атомомами углерода и атомом кислорода. Такая изомеризация происходит из-за большей плотности двойной связи С=О по сравнению с С=С.
Только ацетилен превращается в альдегид, его гомологи — в кетоны. Реакция протекает по правила Марковникова:
Эта реакция носит названия – реакции Кучерова.
4. Те алкины, которые имеют концевую тройную связь, могут отщеплять протон под действием сильных кислотных реагентов. Такой процесс обусловлен сильной поляризацией связи .
Причиной поляризации служит сильная электроотрицательность атома углерода в sp-гибридизации, поэтому алкины могут образовывать соли – ацетилениды:
Ацетилениды меди и серебра легко образуются и выпадают в осадок (при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди). Эти реакции являются качественными на концевую тройную связь:
Полученные соли легко разлагаются под действием HCl, в результате выделяется исходный алкин:
Поэтому алкины легко выделить из смеси других углеводородоров.
5. Полимеризация. При участии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий, могут образовываться различные продукты. Например, под воздействием хлорида меди (I) и хлорида аммония:
Винилацетилен (полученное соединение) присоединяет хлороводород, образуя хлорпрен, который служит сырьем для получения синтетического каучука:
6. Если ацетилен пропускать через уголь при 600 ºС, получают ароматическое соединение – бензол. Из гомологов ацетилена, получают гомологи бензола:
7. Реакция окисления и восстановления. Алкины легко окисляются перманганатом калия. Раствор обесцвечивается, т.к. в исходном соединении есть тройная связь. При окислении происходит расщепление тройной связи с образованием карбоновой кислоты:
В присутствие металлических катализаторов происходит восстановление водородом:
Схема применения этилена
Этилен используют в двух основных категориях: в качестве мономера, из которого построены большие углеродные цепи, и в качестве исходного материала для других двух-углеродных соединений. Полимеризации — это повторяющиеся объединения множества мелких молекул этилена в более крупные. Этот процесс происходит при высоких давлениях и температурах. Области применения этилена многочисленны. Полиэтилен – это полимер, который используется особенно массово в производстве упаковочных пленок, проволочных покрытий и пластиковых бутылок. Еще одно применение этилена в качестве мономера касается формирования линейных α-олефинов. Этилен является исходным материалом для приготовления ряда двух-углеродных соединений, таких как этанол (технический спирт), окись этилена (антифриз, полиэфирные волокна и пленки), ацетальдегида и винил хлорида. Кроме этих соединений, этилен с бензолом образует этилбензол, который используется в производстве пластмасс и синтетического каучука. Рассматриваемое вещество является одним из простейших углеводородов. Однако свойства этилена делают его биологически и хозяйственно значимым.
5. Применение
В современной промышленности этилен применяется достаточно широко для синтеза этилового спирта и производства важных полимерных материалов (полиэтилен и др.)., А также для синтеза других органических веществ. Очень интересна свойство этилена ускорять созревание многих огородных и садовых плодов (помидоров, дынь, груш, лимонов и т.п.). Используя это, плоды можно транспортировать еще зелеными, а затем доводить их до спелого состояния уже на месте потребления, вводя в воздух складских помещений небольшие количества этилена.
Из этилена производят хлористый винил и поливинилхлорид, бутадиен и синтетические каучуки, оксид этилена и полимеры на его основе, этиленгликоль и т.д..